摘要: 镍镉可充电电池在现代生活中有广泛应用.已知某镍镉电池的电解质溶液为KOH溶液.其充.放电按下式进行:Cd + 2NiOOH + 2H2OCd(OH)2 + 2Ni(OH)2 有关该电池的说法正确的是( ) A.充电时阳极反应:Ni(OH)2-e- + OH- == NiOOH + H2O B.充电过程是化学能转化为电能的过程 C.放电时负极附近溶液的碱性不变 D.放电时电解质溶液中的OH-向正极移动
网址:http://m.1010jiajiao.com/timu3_id_293992[举报]
(2008?江苏)将一定量的SO2和含0.7mol氧气的空气(忽略CO2)放入一定体积的密闭容器中,550℃时,在催化剂作用下发生反应:2SO2+O2
2SO3(正反应放热).反应达到平衡后,将容器中的混合气体通过过量NaOH溶液,气体体积减少了21.28L;再将剩余气体通过焦性没食子酸的碱性溶液吸收O2,气体的体积又减少了5.6L(以上气体体积均为标准状况下的体积).(计算结果保留一位小数)
请回答下列问题:
(1)判断该反应达到平衡状态的标志是
a.SO2和SO3浓度相等 b.SO2百分含量保持不变
c.容器中气体的压强不变 d.SO3的生成速率与SO2的消耗速率相等
e.容器中混合气体的密度保持不变
(2)欲提高SO2的转化率,下列措施可行的是
a.向装置中再充入N2 b.向装置中再充入O2
c.改变反应的催化剂 d.升高温度
(3)求该反应达到平衡时SO2的转化率(用百分数表示).
(4)若将平衡混合气体的5%通入过量的BaCl2溶液,生成沉淀多少克?
查看习题详情和答案>>
| 催化剂 | △ |
请回答下列问题:
(1)判断该反应达到平衡状态的标志是
bc
bc
.(填字母)a.SO2和SO3浓度相等 b.SO2百分含量保持不变
c.容器中气体的压强不变 d.SO3的生成速率与SO2的消耗速率相等
e.容器中混合气体的密度保持不变
(2)欲提高SO2的转化率,下列措施可行的是
b
b
.(填字母)a.向装置中再充入N2 b.向装置中再充入O2
c.改变反应的催化剂 d.升高温度
(3)求该反应达到平衡时SO2的转化率(用百分数表示).
(4)若将平衡混合气体的5%通入过量的BaCl2溶液,生成沉淀多少克?
(2008?江苏)工业上制备BaCl2的工艺流程图如下: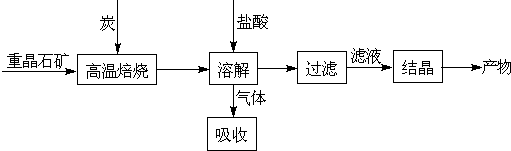
某研究小组在实验室用重晶石(主要成分BaSO4)对工业过程进行模拟实验.查表得
BaSO4(s)+4C(s)
4CO(g)+BaS(s)△H1=571.2kJ?mol-1 ①
BaSO4(s)+2C(s)
2CO2(g)+BaS(s)△H2=226.2kJ?mol-1 ②
(1)气体用过量NaOH溶液吸收,得到硫化钠.Na2S水解的离子方程式为
(2)向BaCl2溶液中加入AgNO3和KBr,当两种沉淀共存时,
=
(3)反应C(s)+CO2(g)
2CO(g)的△H2=
(4)实际生产中必须加入过量的炭,同时还要通入空气,其目的是
查看习题详情和答案>>

某研究小组在实验室用重晶石(主要成分BaSO4)对工业过程进行模拟实验.查表得
BaSO4(s)+4C(s)
| ||
BaSO4(s)+2C(s)
| ||
(1)气体用过量NaOH溶液吸收,得到硫化钠.Na2S水解的离子方程式为
S2-+H2O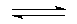 HS-+OH-;HS-+H2O
HS-+OH-;HS-+H2O H2S+OH-
H2S+OH-
S2-+H2O HS-+OH-;HS-+H2O
HS-+OH-;HS-+H2O H2S+OH-
H2S+OH-
;(2)向BaCl2溶液中加入AgNO3和KBr,当两种沉淀共存时,
| c(Br-) |
| c(Cl-) |
2.7×10-3
2.7×10-3
;[Ksp(AgBr)=5.4×10-13,Ksp(AgCl)=2.0×10-10](3)反应C(s)+CO2(g)
| ||
172.5
172.5
kJ?mol-1;(4)实际生产中必须加入过量的炭,同时还要通入空气,其目的是
使BaSO4得到充分的还原(或提高BaS的产量),①②为吸热反应,炭和氧气反应放热维持反应所需高温.
使BaSO4得到充分的还原(或提高BaS的产量),①②为吸热反应,炭和氧气反应放热维持反应所需高温.
.|
2007年5月,江苏无锡太湖水域爆发蓝藻,2008年2月,湖北又报道某水域爆发蓝藻.蓝藻的形成是由于含N、P等元素的废水排入水域,引发蓝藻的疯狂生长.通过定量实验,分析得知某蓝藻的组成为(质量分数):C:35.80%,O:49.50%,P:0.87%,H:7.37%,N:6.31%.则该蓝藻的实验式(最简式)为 | |
| [ ] | |
A. |
C106H263O110N16P |
B. |
C106H263O111N15P |
C. |
C106H262O111N17P |
D. |
C105H262O110N14P |