摘要:17.Pb2+离子的价电子结构是 ( ) A.5s2 B.6s26p6 C.5s25p6 D.5s25p65d106s2
网址:http://m.1010jiajiao.com/timu3_id_293118[举报]
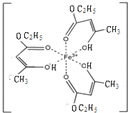 Ⅰ.氯化铁溶液用于检验食用香精乙酰乙酸乙酯时,会生成紫色配合物,其配离子结构如右图所示.
Ⅰ.氯化铁溶液用于检验食用香精乙酰乙酸乙酯时,会生成紫色配合物,其配离子结构如右图所示.(1)此配合物中,铁离子的价电子排布式为
(2)此配离子中含有的作用力有
A.离子键 B.金属键 C.极性键 D.非极性键
E.配位键 F.氢键 G.σ键 H.π键
(3)此配合物中碳原子的杂化轨道类型有
Ⅱ.元素A的基态原子占据纺锤形原子轨道的电子总数为2,元素B与A同周期,其基态原子占据s轨道的电子数与p轨道相同;C是A的同族相邻元素,电负性小于A;D是B的同族相邻元素,第一电离能小于B.则:
(4)化合物CA和DB2的晶体熔点较高的是
(5)AD2分子的空间构型为
(6)A、B和C的成键情况如下:
| A-B | A=B | C-B | C=B | |
| 键能/kJ?mol-1 | 360 | 803 | 464 | 640 |
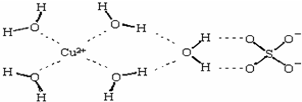 第四周期的Cr、Fe、Co、Ni、Cu、Zn等许多金属能形成配合物.
第四周期的Cr、Fe、Co、Ni、Cu、Zn等许多金属能形成配合物.(1)Cr的核外电子排布式为
1s22s22p63s23p63d54s1
1s22s22p63s23p63d54s1
;(2)科学家通过X射线测得胆矾结构示意图可简单表示如下:图中虚线表示的作用力为
氢键、配位键
氢键、配位键
;(3)胆矾溶液与氨水在一定条件下可以生成Cu(NH3)4SO4?H2O晶体.在Cu(NH3)4SO4?H2O晶体中,[Cu(NH3)4]2+ 为平面正方形结构,则呈正四面体结构的原子团是
SO42-
SO42-
,该原子团中心原子的杂化轨道类型是sp3
sp3
;(4)在一定条件下,Cu+比Cu2+稳定,请解释其原因:
Cu+基态离子的价电子排布为3d10,Cu2+基态离子的价电子排布为3d9,前者为半充满,所以Cu+比Cu2+稳定
Cu+基态离子的价电子排布为3d10,Cu2+基态离子的价电子排布为3d9,前者为半充满,所以Cu+比Cu2+稳定
(5)金属镍粉在CO气流中轻微加热,生成无色挥发性液态Ni(CO)4,呈正四面体构型.试推测四羰基镍的晶体类型是
分子晶体
分子晶体
,Ni(CO)4易溶于BC
BC
.A.水 B.四氯化碳 C.苯 D.硫酸镍溶液.
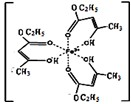 不锈钢以其优异的抗腐蚀性能越来越受到人们的青睐,它主要是由铁、铬、镍、铜、碳等元素所组成的合金.
不锈钢以其优异的抗腐蚀性能越来越受到人们的青睐,它主要是由铁、铬、镍、铜、碳等元素所组成的合金.Ⅰ氯化铁溶液用于检验食用香精乙酰乙酸乙酯时,会生成紫色配合物,其配离子结构如图所示.
(1)此配合物中,铁离子的价电子排布式为
(2)此配合物中碳原子的杂化轨道类型有
Ⅱ(1)[Cr (H2O)4Cl2]C1?2H2O中Cr的配位数为
(2)金属镍粉在CO气流中轻微加热,生成无色挥发性液体Ni(CO)n,与Ni(CO)n中配体互为等电子体的离子的化学式为
(3)铜是第四周期最重要的过渡元素之一,其单质及化合物具有广泛用途. CuH的晶体结构如图
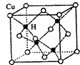 所示,若CuH的密度为d g/cm3,阿伏加德罗常数的值为NA,则该晶胞的边长为
所示,若CuH的密度为d g/cm3,阿伏加德罗常数的值为NA,则该晶胞的边长为 原子序数小于36的x、Y、z、w四种元素,元素x的原子核外最外层电子数是内层电子数的2倍,元素Y与x同周期,其基态原子占据s轨道的电子数与占据p轨道的电子数相同,z是x的同族相邻元素;w是第Ⅷ族元素中原子序数最小的元素.用元素符号回答下列问题:
原子序数小于36的x、Y、z、w四种元素,元素x的原子核外最外层电子数是内层电子数的2倍,元素Y与x同周期,其基态原子占据s轨道的电子数与占据p轨道的电子数相同,z是x的同族相邻元素;w是第Ⅷ族元素中原子序数最小的元素.用元素符号回答下列问题:(1)X、Y、Z的电负性由小到大的顺序是
Si<C<O
Si<C<O
.(2)N3一与x、Y形成的一种化合物互为等电子体,则N3一的空
间构型为
直线型
直线型
、电子式为

(3)同为原子晶体的XY2与ZY2中硬度小的是
SiO2
SiO2
.(4)X和W所形成的某种晶体结构如图所示,写出:
①基态W2+离子的价电子排布式
3d6
3d6
;②该晶体的化学式
FeC
FeC
.下表是元素周期表的一部分.表中所列的字母分别代表某一种化学元素.

(1)X原子的价电子排布式是:
(2)M元素在周期表中的位置是第
(3)Q、R、M的第一电离能由大到小的顺序是
(4)E与Q所形成的化合物含
(5)Fe2+与Mn2+两种离子,
(6)用氢键表示式写出W的氢化物溶液中存在的所有氢键
查看习题详情和答案>>

(1)X原子的价电子排布式是:
3d104s1
3d104s1
;(2)M元素在周期表中的位置是第
二
二
周期第ⅥA
ⅥA
族;(3)Q、R、M的第一电离能由大到小的顺序是
N>O>C
N>O>C
(用元素符号表示);(4)E与Q所形成的化合物含
极性
极性
键,属非极性
非极性
分子.(填“极性”或“非极性”)(5)Fe2+与Mn2+两种离子,
Fe2+
Fe2+
更容易再失去1个电子,原因是亚铁离子的价电子式为3d6,锰离子的价电子式为3d5,d轨道处于半充满状态更稳定,而亚铁离子需要失去一个电子才达到半充满稳定状态,所以亚铁离子更容易再失去1个电子
亚铁离子的价电子式为3d6,锰离子的价电子式为3d5,d轨道处于半充满状态更稳定,而亚铁离子需要失去一个电子才达到半充满稳定状态,所以亚铁离子更容易再失去1个电子
.(6)用氢键表示式写出W的氢化物溶液中存在的所有氢键
F-H…F、F-H…O、O-F…F、O-H…O
F-H…F、F-H…O、O-F…F、O-H…O
.