摘要:通过上面的实验.我们可以看出.室温时.20 mL水中溶解氯化钠和硝酸钾的质量差不多.但升高温度.硝酸钾比氯化钠溶解的要多.通常我们可以用溶解度来定量表示物质的溶解能力.1.固体物质的溶解度 (1)概念 固体物质的溶解度是指在一定温度下.该物质在100 g溶剂达到饱和状态时所溶解的质量. 说明:①条件:在一定温度下. 温度是影响固体物质溶解度的重要因素.不同温度下.固体物质的溶解度不同.如硝酸钾在20 ℃的溶解度是31.6 g.而在60 ℃的溶解度是110 g.因此只有指明温度时.溶解度才有意义. ②标准:在100 g溶剂里. 溶解度的标准是统一的.即规定在100 g溶剂里.这里尤其需要注意.是在100 g溶剂里.而不是在100 g溶液里. ③状态:达到饱和状态. 达到饱和状态.即物质的溶解达到了最大限度.才能体现出某种物质的溶解能力大小. ④量:质量.单位通常为克. 状元笔记 理解溶解度概念要抓住四个要素.即①条件:一定温度,②标准:100 g溶剂,③状态:饱和状态,④量:质量(克). (2)固体溶解度与溶解性的关系 溶解性 易溶 可溶 微溶 难溶 溶解度/g 大于10 1-10 0.01-1 小于0.01 说明:室温一般指的是在20 ℃时. [示例]下列对“20 ℃时.硝酸钾的溶解度为31.6 g 的解释正确的是( ) A.20 ℃时.31.6 g硝酸钾溶解在水中 B.20 ℃时.100 g溶液中含31.6 g硝酸钾 C.31.6 g硝酸钾溶解在100 g水中达到饱和状态 D.20 ℃时.31.6 g硝酸钾溶解在100 g水中恰好达到饱和状态 解析:固体物质的溶解度是指在一定温度下某固态物质在100 g溶剂里达到饱和状态时所溶解的质量.A中未指明溶剂量100 g及溶液达到饱和状态,B中溶液为100 g而不是溶剂为100 g.也未指明溶液达到饱和状态,C中未指明温度.因此A.B.C都是错误的.只有D的理解符合溶解度的四要素.是正确的. 答案:D
网址:http://m.1010jiajiao.com/timu3_id_29255[举报]
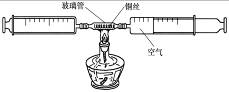
在测定空气中氧气含量的实验中,小强采用了右图所示装置:在由两个注射器组成的密闭系统中留有25mL空气,给装有细铜丝的玻璃管加热,同时缓慢推动两个注射器活塞,至玻璃管内的铜丝在较长时间内无进一步变化时停止加热,待冷却至室温,将气体全部推至一个注射器内,观察密闭系统内空气体积变化。
(1)在实验加热过程中,交替缓慢推动两个注射器活塞的目的是 。
(2)写出该实验中反应的化学方程式 。
(3)小强测得实验结果如下:
反应前注射器内气体总体积 | 反应后注射器内气体总体积 |
25mL | 22mL |
由此数据可以推算出他测定的空气中氧气的体积分数 2l%(填“>”、“=”、 “<”)。造成该实验出现误差的原因可能是 。(填序号)
①没有交替缓缓推动两个注射器活塞;②读数时没有冷却至室温;③加入铜丝量太少;④加入铜丝量太多
(4)通过上面的实验,你学到的测量混合物中某成分含量的方法是
。
在测定空气中氧气含量的实验中,小强采用了下图所示装置:在由注射器和具支试管组成的密闭系统中留有25mL空气,给装有铜粉的具支试管加热,同时缓慢推拉注射器活塞,待注射器活塞稳定后,观察密闭系统内空气体积变化.
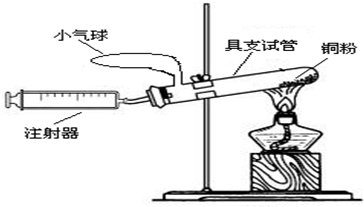
(1)在实验加热过程中,具支试管上的小气球作用是
(2)写出该实验中反应的化学方程式
(3)小强测得实验结果如下:
由此数据可以推算出他测定的空气中氧气的体积分数
(4)通过上面的实验,你学到的测量空气中氧气含量的方法是
查看习题详情和答案>>

(1)在实验加热过程中,具支试管上的小气球作用是
缓冲压力
缓冲压力
.(2)写出该实验中反应的化学方程式
2Cu+O2
2CuO
| ||
2Cu+O2
2CuO
.
| ||
(3)小强测得实验结果如下:
| 反应前装置内气体总体积 | 反应后装置内气体总体积 |
| 25mL | 22mL |
<
<
2l%(填“>”、“=”、“<”).造成该实验出现误差的原因可能是①②③
①②③
.(填序号)①没有推拉注射器活塞;②读数时没有冷却至室温;③加入铜丝量太少;④加入铜丝量太多(4)通过上面的实验,你学到的测量空气中氧气含量的方法是
利用化学反应,在不引入新的气体杂质的前提下,将氧气转化为固体,从而达到测定空气中氧气含量的目的
利用化学反应,在不引入新的气体杂质的前提下,将氧气转化为固体,从而达到测定空气中氧气含量的目的
.
在测定空气中氧气含量的实验中,小强采用了如图所示装置:在由两个注射器组成的密闭系统中留有25mL空气,给装有细铜丝的玻璃管加热,同时缓慢推动两个注射器活塞,至玻璃管内的铜丝在较长时间内无进一步变化时停止加热,待冷却至室温,将气体全部推至一个注射器内,观察密闭系统内空气体积变化.
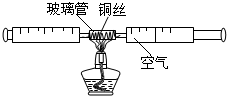
(1)在实验加热过程中,交替缓慢推动两个注射器活塞的目的是 .
(2)写出该实验中反应的化学方程式 .
(3)小强测得实验结果如下:
由此数据可以推算出他测定的空气中氧气的体积分数 2l%(填“>”、“=”、“<”).造成该实验出现误差的原因可能是 .(填序号)
①没有交替缓缓推动两个注射器活塞;②读数时没有冷却至室温;③加入铜丝量太少;④加入铜丝量太多
(4)通过上面的实验,你学到的测量混合物中某成分含量的方法是 .
查看习题详情和答案>>

(1)在实验加热过程中,交替缓慢推动两个注射器活塞的目的是
(2)写出该实验中反应的化学方程式
(3)小强测得实验结果如下:
| 反应前注射器内气体总体积 | 反应后注射器内气体总体积 |
| 25mL | 22mL |
①没有交替缓缓推动两个注射器活塞;②读数时没有冷却至室温;③加入铜丝量太少;④加入铜丝量太多
(4)通过上面的实验,你学到的测量混合物中某成分含量的方法是
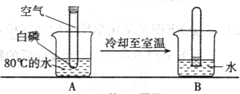 某课外活动小组在学习了书本“空气中氧气含量的测定”实验,知道P2O5不能随便排放在空气中,否则会对空气造成污染,所以对该实验进行了改进,如右图所示:
某课外活动小组在学习了书本“空气中氧气含量的测定”实验,知道P2O5不能随便排放在空气中,否则会对空气造成污染,所以对该实验进行了改进,如右图所示:请根据你对上述实验的理解,回答下列问题:
(1)A中的实验现象是
白磷燃烧生成大量白烟
白磷燃烧生成大量白烟
.(2)写出该反应的符号表达式
P+O2
P2O5
| 点燃 |
P+O2
P2O5
.| 点燃 |
(3)实验结束后,试管内的气体体积理论上应该减少约为试管容积的
| 1 |
| 5 |
| 1 |
| 5 |
(4)上述实验只是粗略测定空气中氧气含量的一种方法,你认为造成该实验不够精确的可能原因是
①②③
①②③
.(填序号)①装置气密性不好②读数时没有冷却至室温;③加入红磷量太少;④加入红磷量太多.
(5)通过上面的实验,你学到的测量混合物中某成分含量的方法是
通过化学反应除去混合物中的一种成分,再测量混合物在反应前后体积(或质量)的变化,从而得出该种成分的含量
通过化学反应除去混合物中的一种成分,再测量混合物在反应前后体积(或质量)的变化,从而得出该种成分的含量
.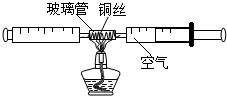 在测定空气中氧气含量的实验中,小强采用了右图所示装置:在由两个注射器组成的密闭系统中留有25mL空气,给装有细铜丝的玻璃管加热,同时缓慢推动两个注射器活塞,至玻璃管内的铜丝在较长时间内无进一步变化时停止加热,生成黑色固体氧化铜,待冷却至室温,将气体全部推至一个注射器内,观察密闭系统内空气体积变化.
在测定空气中氧气含量的实验中,小强采用了右图所示装置:在由两个注射器组成的密闭系统中留有25mL空气,给装有细铜丝的玻璃管加热,同时缓慢推动两个注射器活塞,至玻璃管内的铜丝在较长时间内无进一步变化时停止加热,生成黑色固体氧化铜,待冷却至室温,将气体全部推至一个注射器内,观察密闭系统内空气体积变化.(1)在实验加热过程中,交替缓慢推动两个注射器活塞的目的是
(2)写出该实验中反应的文字表达式
(3)小强测得实验结果如下:
| 反应前注射器内气体总体积 | 反应后注射器内气体总体积 |
| 25mL | 22mL |
①没有交替缓缓推动两个注射器活塞;②读数时没有冷却至室温;③加入铜丝量太少;④加入铜丝量太多
(4)通过上面的实验,你学到的测量混合物中某成分含量的方法是
. 查看习题详情和答案>>