网址:http://m.1010jiajiao.com/timu3_id_2910[举报]
(1)冶炼技术在中国有着悠久的历史.如图表示了金属活动性顺序表中铜、锡、铁和铝元素被人类大规模开发、利用的大致年限:
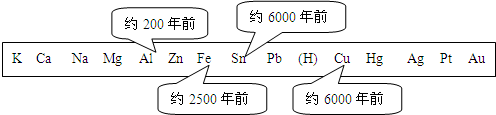
①根据图中数据和有关的化学知识,你认为金属大规模开发、利用的先后顺序跟下列哪些因素有关?
a.地壳中金属元素的含量 b.金属的导电性 c.金属的活动性
d.金属的延展性 e.金属冶炼的难易程度
②常温下铝是一种活泼金属,但铝却有较强的抗腐蚀性,其原因是
③我国古代将炉甘石(ZnCO3)、赤铜矿(主要成分为Cu2O)和木炭粉混合加热至800℃左右,即可得到金光闪闪与黄金外观相似的“药金”.
a.用上述方法不能制得黄金是因为
b.药金的主要成分是
(2)每年世界上钢铁的产量很高,但钢铁的锈蚀也给人类带来巨大的损失.
①铁在地壳中的含量居所有金属元素的第
②铁在空气中锈蚀,实际上是铁跟
③据报道,全世界每年因金属腐蚀造成的直接经济损失约达7000亿美元,我国因金属腐蚀造成 的损失占国民生产总值(GNP)的4%.
请你根据不同原理,提出防止钢铁锈蚀的两条合理措施:
a.
b.
金属与我们的生活息息相关,在各个领域中用途广泛.
(1)我国第四套人民币硬币从1999年开始发行,一元币为钢芯镀镍(Ni),伍角币为钢芯镀铜合金,一角币为铝合金或不锈钢.选择铸造硬币的材料不需要考虑的因素是 (填序号).
| A.金属的硬度 | B.金属的导电性; |
| C.金属的耐腐蚀性 | D.金属价格与硬币面值的吻合度. |
(3)高铁酸钠(Na2FeO4)是一种“绿色环保高效”消毒剂.高铁酸钠中铁元素的化合价为 价.
(4)在质量相等、溶质质量分数相同的稀硫酸中,分别加入等质量的锌粉和铁粉,生成氢气质量(m)随反应时间(t)的变化曲线如图所示.下列表述正确的是 (填序号).
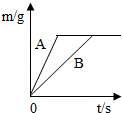
①A表示锌和稀硫酸的反应曲线
②反应结束后消耗两种金属的质量相等
③反应结束后稀硫酸都没有剩余
④反应结束后两种金属一定都有剩余
⑤反应结束后生成的氢气质量相等 查看习题详情和答案>>
 金属与我们的生活息息相关,在各个领域中用途广泛.
金属与我们的生活息息相关,在各个领域中用途广泛.
(1)我国第四套人民币硬币从1999年开始发行,一元币为钢芯镀镍(Ni),伍角币为钢芯镀铜合金,一角币为铝合金或不锈钢.选择铸造硬币的材料不需要考虑的因素是______(填序号).
A、金属的硬度; B、金属的导电性;
C、金属的耐腐蚀性;D、金属价格与硬币面值的吻合度.
(2)在“南海一号”打捞出来的文物中,“金龙纹手镯”光彩夺目,完好无损;铜镜表面有铜锈;铁器则锈迹斑斑,残存很少.这说明金、铜、铁这三种金属的活动性由强到弱的顺序是______.
(3)高铁酸钠(Na2FeO4)是一种“绿色环保高效”消毒剂.高铁酸钠中铁元素的化合价为______价.
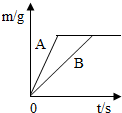
(4)在质量相等、溶质质量分数相同的稀硫酸中,分别加入等质量的锌粉和铁粉,生成氢气质量(m)随反应时间(t)的变化曲线如图所示.下列表述正确的是______(填序号).
①A表示锌和稀硫酸的反应曲线
②反应结束后消耗两种金属的质量相等
③反应结束后稀硫酸都没有剩余
④反应结束后两种金属一定都有剩余
⑤反应结束后生成的氢气质量相等.
查看习题详情和答案>>
金属与我们的生活息息相关,在各个领域中用途广泛.
(1)我国第四套人民币硬币从1999年开始发行,一元币为钢芯镀镍(Ni),伍角币为钢芯镀铜合金,一角币为铝合金或不锈钢.选择铸造硬币的材料不需要考虑的因素是 (填序号).
A、金属的硬度; B、金属的导电性;
C、金属的耐腐蚀性;D、金属价格与硬币面值的吻合度.
(2)在“南海一号”打捞出来的文物中,“金龙纹手镯”光彩夺目,完好无损;铜镜表面有铜锈;铁器则锈迹斑斑,残存很少.这说明金、铜、铁这三种金属的活动性由强到弱的顺序是 .
(3)高铁酸钠(Na2FeO4)是一种“绿色环保高效”消毒剂.高铁 酸钠中铁元素的化合价为 价.
酸钠中铁元素的化合价为 价.
(4)在质量相等、溶质质量分数相同的稀硫酸中,分别加入等质量的锌粉和铁粉,生成氢气质量(m)随反应时间(t)的变化曲线如图所示.下列表述正确的是 (填序号).
①A表示锌和稀硫酸的反应曲线
②反应结束后消耗两种金属的质量相等
③反应结束后稀硫酸都没有剩余
④反应结束后两种金属一定都有剩余
⑤反应结束后生成的氢气质量相等.
金属是现代生活、工业生产以及科学研究中应用极为普遍的一类材料。
(1)青少年看书、写字一定要爱护眼睛,台灯是在光线不足时常用的照明用具。
 ①右图所示的台灯,序号标示的物质中属于金属材料的有 ▲ (填序号);小明发现台灯的铁螺丝钉表面已经锈蚀,原因是铁与空气中的氧气及 ▲ 等发生了化学反应。
①右图所示的台灯,序号标示的物质中属于金属材料的有 ▲ (填序号);小明发现台灯的铁螺丝钉表面已经锈蚀,原因是铁与空气中的氧气及 ▲ 等发生了化学反应。
②小红发现铝箔反光片呈银白色,无锈迹,原因是铝表面有一层致密的氧化膜,生成该氧化膜的化学方程式为 ▲ 。
(2)如图是三种常见金属在稀盐酸反应的现象示意图。
 ①A、B、C三种金属的活动性由强到弱的顺序是
①A、B、C三种金属的活动性由强到弱的顺序是
▲ 。
②若金属C是世界年产量最多应用最广的金属,C元素在地壳中含量位居第四。其与稀盐酸发生反应后的溶液中,溶质一定有 ▲ (写化学式)。
③若A、B分别为镁和锌,等质量的A、B在足量的盐酸中反应生成氢气质量较大的是 ▲ 。(选填A或B)
(3)金属的开发和利用是人类文明和社会进步的标志。
①我国古代将炉甘石(ZnCO3)、赤铜矿(Cu2O)和木炭粉混合加热至800℃左右,即可得到与黄金外观相似的“药金”。“药金”是 ▲ (填“纯金属”或“合金”);
②钛(元素符号Ti)因常温下不与酸、碱反应等优良的性能,被誉为“未来金属”。由钒钛磁铁矿提取金属钛的主要工艺过程如下:

I.TiCl4在高温下与足量Mg反应置换生成金属Ti,该反应的化学方程式为:
▲ 。
II.上述生产过程中得到的金属钛中混有少量金属杂质,可加入 ▲ 除去。
查看习题详情和答案>>