网址:http://m.1010jiajiao.com/timu3_id_290385[举报]
某化学兴趣小组测定某Fe2(SO4)3样品(只含少量FeCl2杂质)中铁元素的质量分数,按以下实验步骤进行操作:
①称取a g样品,置于烧杯中;
②加入50 mL 1.0 mol/L稀硫酸和一定量的蒸馏水,使样品溶解,然后准确配制成250.00 mL溶液;
③量取25.00 mL步骤②中配得的溶液,置于烧杯中,加入适量的氯水,使反应完全;
④加入过量氨水,充分搅拌,使沉淀完全;
⑤过滤,洗涤沉淀;
⑥将沉淀转移到某容器内,加热、搅拌,直到固体由红褐色全部变为红棕色后,在干燥器中冷却至室温后,称量;
⑦……
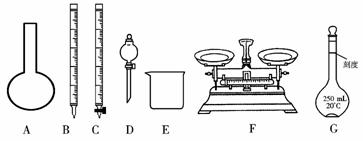
请根据上面叙述,回答:
(1)上图所示仪器中,本实验步骤①②③中必须用到的仪器有E和____________(填字母)。
(2)步骤②中:配制50 mL,1.0 mol/L稀H2SO4需要98%(密度1.84 g/cm3)的浓H2SO4体积为____________ mL,量取该体积的浓H2SO4用到量筒规格是____________。
(3)样品中的杂质Fe2+有较强的还原性,完成并配平下列反应的离子方程式
□Fe2++□ClO2□□=□Fe3++□Cl-+□H2O
从理论上分析,上述实验中若将氯水改为ClO2时,对实验结果造成____________(填“偏大”“偏小”或“不影响”),等物质的量的ClO2与Cl2的氧化效率之比为____________。
(4)第⑥步的操作中,将沉淀物转移到____________(填仪器名称)中加热,冷却至室温,称量其质量为m1 g,再次加热并冷却至室温称量其质量为m2 g,若m1与m2差值较大,接下来的操作应当是____________。
(5)若步骤⑥不在干燥器中冷却,则测定的铁元素的质量分数会____________(填“偏大”“偏小”或“不影响”);若容器质量是W1 g,最终容器和固体的总质量是W2 g,则样品中铁元素的质量分数为____________(列出算式,不需化简)。
查看习题详情和答案>>NaClO3+A+B→NaCl+C+H2O.
(1)请完成以上化学方程式:
(2)配平下列离子方程式,并回答问题:
(3)已知有3.21g Fe(OH)3参加反应,共转移了5.418×1022个电子,则n=
(4)根据上述(2 ),(3)题推测FeO4n-能与下列哪些物质反应(只填序号)
A.Cl2 B.SO2 C.H2S D.O2? 查看习题详情和答案>>
工业上为从4J29合金(铁钴镍合金)废料中提取钴和镍,一般先用硫酸溶解合金使成为Fe2+、Co2+、Ni2+,再把Fe2+氧化为Fe3+,从而使Fe3+转化为某种沉淀析出,达到与Ni2+、Co3+分离的目的.生产上要使Fe2+氧化为Fe3+,而不使Co2+、Ni2+氧化的试剂是NaClO或NaClO3(均含少量H2SO4)溶液,反应的部分化学方程式如下(A为还原剂):??NaClO+A+B→NaCl+C+H2O
NaClO3+A+B→NaCl+C+H2O.
(1)请完成以上化学方程式:______,______.并回答实际生产上采用NaClO3来氧化Fe2+比较合算的理由:______.
(2)配平下列离子方程式,并回答问题:
______Fe(OH)3+______ClO-+______OH-→______FeO4n-+______Cl-+______H20?
(3)已知有3.21g Fe(OH)3参加反应,共转移了5.418×1022个电子,则n=______.
(4)根据上述(2 ),(3)题推测FeO4n-能与下列哪些物质反应(只填序号)______.
A.Cl2 B.SO2 C.H2S D.O2?
查看习题详情和答案>>
NaClO+
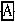 +
+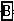 =NaCl+
=NaCl+ +H2O
+H2ONaClO3+
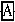 +
+ =NaCl+
=NaCl+ +H2O
+H2O(1)请完成以上化学方程式,并回答实际生产上采用哪种试剂来氧化Fe2+比较合算。
(2)配平化学方程式:
 Fe(OH)3+
Fe(OH)3+ ClO-+
ClO-+ OH-→
OH-→ Fe
Fe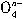 +
+ Cl- +
Cl- + H2O。
H2O。(3)已知有3.21gFe(OH)3参加反应,共转移了5.42×1022个电子,则n=____________,Fe
 中铁的化合价为_____________________。
中铁的化合价为_____________________。(4)根据(2)、(3)推测Fe
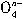 能与下列哪些物质反应(只填序号)______________。
能与下列哪些物质反应(只填序号)______________。A.Cl2 B.SO2 C.H2S D.O2 查看习题详情和答案>>
(1)请完成以上化学方程式,并回答实际生产中采用NaClO3来氧化Fe2+比较好的理由。
(2)配平下列离子方程式,并回答下列问题:
①□Fe(OH)3+□ClO-+□OH-====□![]() +□Cl-+□H2O
+□Cl-+□H2O
②已知有3.21 g Fe(OH)3参加反应,共转移了5.42×1022个电子,则n=_________,![]() 中铁的化合价为_____________。
中铁的化合价为_____________。
③根据①②推测,![]() 能与下列哪些物质反应_________(只填序号)。
能与下列哪些物质反应_________(只填序号)。
A.Cl2 B.SO2
C.H2S D.O2
查看习题详情和答案>>