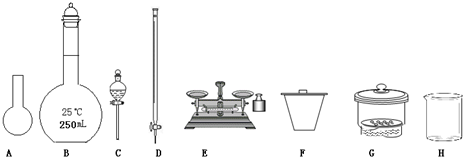
题目内容
某化学兴趣小组测定某Fe2(SO4)3样品(只含少量FeCl2杂质)中铁元素的质量分数,按以下实验步骤进行操作:
①称取a g样品,置于烧杯中;
②加入50 mL 1.0 mol/L稀硫酸和一定量的蒸馏水,使样品溶解,然后准确配制成250.00 mL溶液;
③量取25.00 mL步骤②中配得的溶液,置于烧杯中,加入适量的氯水,使反应完全;
④加入过量氨水,充分搅拌,使沉淀完全;
⑤过滤,洗涤沉淀;
⑥将沉淀转移到某容器内,加热、搅拌,直到固体由红褐色全部变为红棕色后,在干燥器中冷却至室温后,称量;
⑦……
请根据上面叙述,回答:
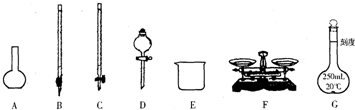
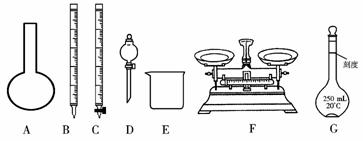
(1)上图所示仪器中,本实验步骤①②③中必须用到的仪器有E和____________(填字母)。
(2)步骤②中:配制50 mL,1.0 mol/L稀H2SO4需要98%(密度1.84 g/cm3)的浓H2SO4体积为____________ mL,量取该体积的浓H2SO4用到量筒规格是____________。
(3)样品中的杂质Fe2+有较强的还原性,完成并配平下列反应的离子方程式
□Fe2++□ClO2□□=□Fe3++□Cl-+□H2O
从理论上分析,上述实验中若将氯水改为ClO2时,对实验结果造成____________(填“偏大”“偏小”或“不影响”),等物质的量的ClO2与Cl2的氧化效率之比为____________。
(4)第⑥步的操作中,将沉淀物转移到____________(填仪器名称)中加热,冷却至室温,称量其质量为m1 g,再次加热并冷却至室温称量其质量为m2 g,若m1与m2差值较大,接下来的操作应当是____________。
(5)若步骤⑥不在干燥器中冷却,则测定的铁元素的质量分数会____________(填“偏大”“偏小”或“不影响”);若容器质量是W1 g,最终容器和固体的总质量是W2 g,则样品中铁元素的质量分数为____________(列出算式,不需化简)。
解析:本题属于综合性很强的实验习题,主要涉及溶液的配制、氧化还原反应的配平、实验操作的设计、实验误差的分析、有关计算,较难。结合实验步骤选择合适的实验仪器;
利用配制前后硫酸的物质的量相等计算出浓硫酸的体积,从而可确定量筒的规格;分析化合价应用原子守恒进行配平,ClO2与氯水的作用一样,均可使Fe2+变为Fe3+,但由于化合价的变化不同,二者的用量不一样,ClO2的用量少,氧化效率更大;加热固体时用坩埚;若不在干燥器中冷却,会使固体吸收空气中的水蒸气,固体质量变大,使结果偏高;根据固体颜色的变化可推知,加热后的固体为Fe2O3,应用铁原子守恒进行计算,一定要注意实验中所取溶液中所含样品的量。
答案:(1)CFG
(2)2.710 mL
(3)5Fe2++ClO2+4H+=5Fe3++Cl-+2H2O不影响5∶2
(4)坩埚继续加热,放置干燥器中冷却,称量,至最后两次称得的质量差不超过0.1 g(或恒量)为止。
(5)偏大[(W2-W1)g/160 g/mol]×2×56 g/mol×(250 m/25 mL)÷a g×100%

 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案