摘要: 碱可以使紫色石蕊试剂变成蓝色,使无色酚酞变成红色.
网址:http://m.1010jiajiao.com/timu3_id_28986[举报]
 小林觉得你很聪明,是他的良师益友,学完“常见的酸和碱”后,邀请你与他讨论相关的知识:
小林觉得你很聪明,是他的良师益友,学完“常见的酸和碱”后,邀请你与他讨论相关的知识:(1)复习酸的化学性质
| ①酸与指示剂作用 | 酸溶液能使紫色石蕊溶液变 (a) 变红 变红 酸溶液不能使无色酚酞溶液变色 | |
| ②酸与多种活泼金属反应,生成氢气 | Zn+2HCl=ZnCl2+H2↑ | Zn+H2SO4=ZnSO4+H2↑ |
| ③酸与某些金属氧化物作用 | Al2O3+6HCl=2AlCl3+3H2O | … |
| ④… | ||
变红
变红
.盐酸、硫酸、食醋具有相似化学性质的原因是因为它们的水溶液中都含有
氢
氢
离子.(2)复习碱的化学性质
为了复习碱的化学性质小林同学重新做了如图所示的探究实验.请协助小林同学回答:
①使用白色点滴板进行实验的优点是
节约药品(可减少对环境的污染;可同时完成多个实验;便于观察实验现象等合理答案均可)
节约药品(可减少对环境的污染;可同时完成多个实验;便于观察实验现象等合理答案均可)
(答一点);②氢氧化钠溶液和氢氧化钙溶液都能使无色的酚酞试液变红,是因为在不同碱的溶液中都含有相同的
氢氧根
氢氧根
离子.③碱除了能和酸碱指示剂显示不同颜色以外,其实还可以与某些非金属氧化物反应,请你帮助小林写出氢氧化钠和二氧化碳反应的化学方程式:
2NaOH+CO2=Na2CO3+H2O
2NaOH+CO2=Na2CO3+H2O
.(3)如何区别常见的酸和碱溶液实验室现有两瓶无色透明溶液,都没有贴好标签,只知道他们分别是氢氧化钠溶液和稀盐酸中的一瓶,请你设计实验区分好两瓶溶液.
取少量试液于两个试管中,分别滴入氢氧化钠溶液和稀盐酸,试液变红的是稀盐酸,试液变蓝的为氢氧化钠溶液
取少量试液于两个试管中,分别滴入氢氧化钠溶液和稀盐酸,试液变红的是稀盐酸,试液变蓝的为氢氧化钠溶液
.
探究是一种重要的学习方式,是充分理解学科本质的基本途径.请你和化学兴趣小组的同学一起完成下面三个探究实验.
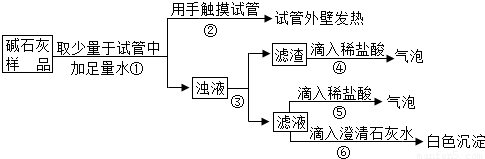
实验一:实验室常用的干燥剂“碱石灰”是CaO和固体NaOH的混合物,极易与空气中水蒸气和CO2反应而变质.兴趣小组的同学对一瓶久置的“碱石灰”作了如下探究:
(1)猜想
猜想Ⅰ:没有变质,“碱石灰”只含有CaO、固体NaOH;
猜想Ⅱ:已完全变质,“碱石灰”全部变成了CaCO3和Na2CO3.
(2)实验
如图所示:
(3)判断
a.若Ca(OH)2、CaCO3和Na2CO3投入到水中不会放热,则由操作②现象判断:猜想Ⅱ______(填:成立、不成立).
b.操作④发生化学反应的方程式为______;由操作⑤⑥的现象判断:滤液中含有______(写化学式);由此判断猜想Ⅰ______(填:成立、不成立).
c.综合a和b的结论,判断该样品变质情况为______.
(4)拓展
由上述实验说明,实验室中“碱石灰”应______保存.
实验二:向NaOH溶液中滴入紫色石蕊试液,溶液显蓝色.
(1)提出问题:是什么粒子使紫色石蕊试液变蓝色呢?
(2)查找资料:NaOH溶液中存在的粒子有大量的H2O、Na+、OH-和极少量的H+.
(3)猜想:是大量的OH-使紫色石蕊试液变蓝色.
(4)实验探究步骤及其说明:
①在一支干净试管中加入2mL蒸馏水,再滴入几滴紫色石蕊试液,溶液几乎不变色,说明______;
②在一支干净试管中加入2mL氯化钠溶液,再滴入几滴紫色石蕊试液,溶液几乎不变色,说明______;
③在一支干净试管中加入2mL______溶液,再滴入几滴紫色石蕊试液,溶液变蓝色,说明OH-能使紫色石蕊试液变蓝色.
(5)结论:原假设______.(填“成立”或“不成立”)
实验三:实验室的废液中,可能含有氯化铁、硫酸、氯化钠、碳酸钠和硝酸钡中的一种或多种.化学兴趣小组的同学对废液进行了如下试验:
(1)取废液观察,为无色溶液;
(2)取废液,向其中滴加氯化钡溶液,有白色沉淀产生,继续加入稀硝酸,无明显现象;
(3)另取废液,向其中加入铁粉后,产生大量气泡.
根据以上试验现象可推断,废液中肯定含有______,肯定不含有______.
通过实验还不能确定是否含有的物质是______.为了确定它是否存在,同学们设计了下面的实验方案,请按同学们的思路填写表:
查看习题详情和答案>>
实验一:实验室常用的干燥剂“碱石灰”是CaO和固体NaOH的混合物,极易与空气中水蒸气和CO2反应而变质.兴趣小组的同学对一瓶久置的“碱石灰”作了如下探究:
(1)猜想
猜想Ⅰ:没有变质,“碱石灰”只含有CaO、固体NaOH;
猜想Ⅱ:已完全变质,“碱石灰”全部变成了CaCO3和Na2CO3.
(2)实验
如图所示:

(3)判断
a.若Ca(OH)2、CaCO3和Na2CO3投入到水中不会放热,则由操作②现象判断:猜想Ⅱ______(填:成立、不成立).
b.操作④发生化学反应的方程式为______;由操作⑤⑥的现象判断:滤液中含有______(写化学式);由此判断猜想Ⅰ______(填:成立、不成立).
c.综合a和b的结论,判断该样品变质情况为______.
(4)拓展
由上述实验说明,实验室中“碱石灰”应______保存.
实验二:向NaOH溶液中滴入紫色石蕊试液,溶液显蓝色.
(1)提出问题:是什么粒子使紫色石蕊试液变蓝色呢?
(2)查找资料:NaOH溶液中存在的粒子有大量的H2O、Na+、OH-和极少量的H+.
(3)猜想:是大量的OH-使紫色石蕊试液变蓝色.
(4)实验探究步骤及其说明:
①在一支干净试管中加入2mL蒸馏水,再滴入几滴紫色石蕊试液,溶液几乎不变色,说明______;
②在一支干净试管中加入2mL氯化钠溶液,再滴入几滴紫色石蕊试液,溶液几乎不变色,说明______;
③在一支干净试管中加入2mL______溶液,再滴入几滴紫色石蕊试液,溶液变蓝色,说明OH-能使紫色石蕊试液变蓝色.
(5)结论:原假设______.(填“成立”或“不成立”)
实验三:实验室的废液中,可能含有氯化铁、硫酸、氯化钠、碳酸钠和硝酸钡中的一种或多种.化学兴趣小组的同学对废液进行了如下试验:
(1)取废液观察,为无色溶液;
(2)取废液,向其中滴加氯化钡溶液,有白色沉淀产生,继续加入稀硝酸,无明显现象;
(3)另取废液,向其中加入铁粉后,产生大量气泡.
根据以上试验现象可推断,废液中肯定含有______,肯定不含有______.
通过实验还不能确定是否含有的物质是______.为了确定它是否存在,同学们设计了下面的实验方案,请按同学们的思路填写表:
| 实验操作步骤 | 实验现象 | 结论 |
| (1)取2ml废液于试管中,向其中滴入足量的______溶液,静置,取上层清液. (2)向清液中滴入几滴______和几滴稀HNO3. | (1)有白色沉淀生生 (2)______ | 废液中不含有该物质. |
查看习题详情和答案>>
(2012?达州)草木灰是一种常见的农家肥料,其主要成分是碳酸钾(K2CO3);硫酸铵[(NH4)2SO4]是一种氮肥.为了给农民朋友提供技术指导,小明对这两种肥料作了相关性质的探究.
【友情提示】:碳酸钾与纯碱具有相似的化学性质;
【实验探究】:并完成以下各题
【交流共享】:①硫酸铵不宜长期使用,易造成土壤酸化而板结;草木灰的使用既实现了变废为宝,还起到了改良酸性土壤的作用;
②草木灰和硫酸铵能否混合使用?(填“能“或“否”)
【知识拓展】:若要鉴别失去标签的碳酸钾和硫酸铵固体,下列试剂不可用的是:
A、水 B、稀盐酸 C、氯化钡溶液 D、无色酚酞试液.
查看习题详情和答案>>
【友情提示】:碳酸钾与纯碱具有相似的化学性质;
【实验探究】:并完成以下各题
| 探究过程 | K2CO3 | (NH4)2SO4 | 结论及化学方程式 |
| ①、分别取碳酸钾和硫酸铵固体,加足量水搅拌,测其温度变化情况 | 得到澄清溶液; 温度无明显变化 |
得到澄清溶液; 温度明显降低 |
都易溶于水; 硫酸铵溶于水时吸收的热量大于放出的热量. |
| ②、取①中溶液分别滴入紫色石蕊试液,观察溶液颜色变化,并判断其酸碱性 | 变蓝 变蓝 |
变红 | 碳酸钾溶液显 碱 碱 性硫酸铵溶液显 酸 酸 性 |
| ③、另取①中溶液分别加入足量稀盐酸,观察现象 | 有大量气泡产生 有大量气泡产生 |
无明显现象 | 写出相关反应的化学方程式: 2HCl+K2CO3=2KCl+CO2↑+H2O 2HCl+K2CO3=2KCl+CO2↑+H2O |
| ④、再取①中溶液分别加入Ba(OH)2溶液,观察现象 | 产生 白色沉淀 |
产生白色沉淀、有刺激性气味的气体生成 产生白色沉淀、有刺激性气味的气体生成 |
(NH4)2SO4与Ba(OH)2溶液反应的化学方程式: (NH4)2SO4+Ba(OH)2=BaSO4↓+2H2O+2NH3↑ |
②草木灰和硫酸铵能否混合使用?(填“能“或“否”)
否
否
【知识拓展】:若要鉴别失去标签的碳酸钾和硫酸铵固体,下列试剂不可用的是:
C
C
.A、水 B、稀盐酸 C、氯化钡溶液 D、无色酚酞试液.
Ⅰ.纯碱的产量是衡量一个国家化学工业发展水平的重要指标.下面是实验室摸拟侯氏制碱法生产原理的主要过程:
①20℃时,向浓氨水中通入足量的二氧化碳得到NH4HCO3饱和溶液;
②向NH4HCO3饱和溶液中加入食盐细粒,并不断搅拌,直到NaHCO3结晶析出完毕;
③将析出的晶体过滤,得到晶体和滤液,洗涤晶体,然后将晶体充分加热,得到Na2CO3;
④向③的滤液中加入食盐细粒,析出NH4Cl晶体,过滤,得到NH4Cl.
(1)请写出步骤②和③的化学方程式.
②: ;
③: .
(2)侯氏制碱法的优点之一是所得的副产品氯化铵是一种氮肥.该化合物遇碱会生成有刺激性气味的气体 (写化学式,下同),此气体可使紫色石蕊试液变蓝,以上反应现象可用于检验氯化铵中的阳离子.若要通过实验区分氯化铵和另一种氮肥硝酸铵,常用的试剂是 溶液,请比较这两种氮肥中氮元素的质量分数:氯化铵 硝酸铵(选填“>”、“<”或“=”).
Ⅱ.侯氏制碱法所得的纯碱中常含有少量氯化钠,现用下图所示装置来测定纯碱样品中碳酸钠的质量分数(铁架台、铁夹等固定用装置已略去).
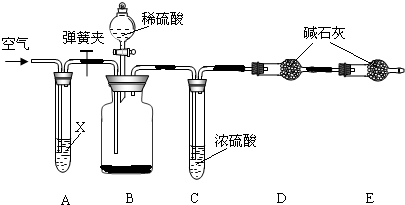
实验步骤如下:
①按图连接装置,并检查气密性;
②准确称得盛有碱石灰(固体氢氧化钠和生石灰的混合物)的干燥管D的质量为83.4g;
③准确称得6.0g纯碱样品放入装置B的广口瓶中;
④打开装置B的分液漏斗旋塞,缓缓滴入稀硫酸,至不再产生气泡为止;
⑤打开弹簧夹,往试管A中缓缓鼓入空气数分钟,然后称得干燥管D的总质量为85.6g.
试回答:
(1)鼓入空气的目的是 ,装置A中试剂X最适宜选用 .
(2)若没有C装置,则会导致测定结果 (填“偏大”或“偏小”).
(3)E装置的作用是 .
(4)请根据实验中测得的有关数据,计算纯碱样品中碳酸钠的质量分数.(要求:写出计算过程,结果保留一位小数) 查看习题详情和答案>>
①20℃时,向浓氨水中通入足量的二氧化碳得到NH4HCO3饱和溶液;
②向NH4HCO3饱和溶液中加入食盐细粒,并不断搅拌,直到NaHCO3结晶析出完毕;
③将析出的晶体过滤,得到晶体和滤液,洗涤晶体,然后将晶体充分加热,得到Na2CO3;
④向③的滤液中加入食盐细粒,析出NH4Cl晶体,过滤,得到NH4Cl.
(1)请写出步骤②和③的化学方程式.
②:
③:
(2)侯氏制碱法的优点之一是所得的副产品氯化铵是一种氮肥.该化合物遇碱会生成有刺激性气味的气体
Ⅱ.侯氏制碱法所得的纯碱中常含有少量氯化钠,现用下图所示装置来测定纯碱样品中碳酸钠的质量分数(铁架台、铁夹等固定用装置已略去).

实验步骤如下:
①按图连接装置,并检查气密性;
②准确称得盛有碱石灰(固体氢氧化钠和生石灰的混合物)的干燥管D的质量为83.4g;
③准确称得6.0g纯碱样品放入装置B的广口瓶中;
④打开装置B的分液漏斗旋塞,缓缓滴入稀硫酸,至不再产生气泡为止;
⑤打开弹簧夹,往试管A中缓缓鼓入空气数分钟,然后称得干燥管D的总质量为85.6g.
试回答:
(1)鼓入空气的目的是
(2)若没有C装置,则会导致测定结果
(3)E装置的作用是
(4)请根据实验中测得的有关数据,计算纯碱样品中碳酸钠的质量分数.(要求:写出计算过程,结果保留一位小数) 查看习题详情和答案>>
