题目内容
Ⅰ.纯碱的产量是衡量一个国家化学工业发展水平的重要指标.下面是实验室摸拟侯氏制碱法生产原理的主要过程:
①20℃时,向浓氨水中通入足量的二氧化碳得到NH4HCO3饱和溶液;
②向NH4HCO3饱和溶液中加入食盐细粒,并不断搅拌,直到NaHCO3结晶析出完毕;
③将析出的晶体过滤,得到晶体和滤液,洗涤晶体,然后将晶体充分加热,得到Na2CO3;
④向③的滤液中加入食盐细粒,析出NH4Cl晶体,过滤,得到NH4Cl.
(1)请写出步骤②和③的化学方程式.
②:________;
③:________.
(2)侯氏制碱法的优点之一是所得的副产品氯化铵是一种氮肥.该化合物遇碱会生成有刺激性气味的气体________(写化学式,下同),此气体可使紫色石蕊试液变蓝,以上反应现象可用于检验氯化铵中的阳离子.若要通过实验区分氯化铵和另一种氮肥硝酸铵,常用的试剂是________溶液,请比较这两种氮肥中氮元素的质量分数:氯化铵________硝酸铵(选填“>”、“<”或“=”).
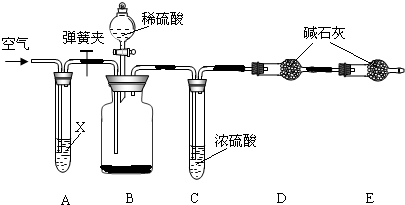
Ⅱ.侯氏制碱法所得的纯碱中常含有少量氯化钠,现用下图所示装置来测定纯碱样品中碳酸钠的质量分数(铁架台、铁夹等固定用装置已略去).

实验步骤如下:
①按图连接装置,并检查气密性;
②准确称得盛有碱石灰(固体氢氧化钠和生石灰的混合物)的干燥管D的质量为83.4g;
③准确称得6.0g纯碱样品放入装置B的广口瓶中;
④打开装置B的分液漏斗旋塞,缓缓滴入稀硫酸,至不再产生气泡为止;
⑤打开弹簧夹,往试管A中缓缓鼓入空气数分钟,然后称得干燥管D的总质量为85.6g.
试回答:
(1)鼓入空气的目的是________,装置A中试剂X最适宜选用________.
(2)若没有C装置,则会导致测定结果________(填“偏大”或“偏小”).
(3)E装置的作用是________.
(4)请根据实验中测得的有关数据,计算纯碱样品中碳酸钠的质量分数.(要求:写出计算过程,结果保留一位小数)
解:Ⅰ.(1)碳酸氢铵和氯化钠反应的化学方程式为:NH4HCO3+NaCl═NH4Cl+NaHCO3↓.
碳酸氢钠受热分解的化学方程式为:2NaHCO3 Na2CO3+H2O+CO2↑.
Na2CO3+H2O+CO2↑.
(2)氯化铵能和碱反应生成氨气,氨气的化学式是NH3.故填:NH3.
氯化铵能和硝酸银反应生成白色沉淀氯化银,硝酸铵不能和硝酸银反应,可以用硝酸银溶液区别氯化铵和硝酸铵,硝酸银的化学式是AgNO3.故填:AgNO3.
氯化铵中氮元素的质量分数为: ×100%=26.2%;
×100%=26.2%;
硝酸铵中氮元素的质量分数为: ×100%=35%.故填:<.
×100%=35%.故填:<.
Ⅱ.(1)鼓入空气的目的是驱赶装置中的气体,使反应生成的二氧化碳气体被D中碱石灰完全吸收.故填:驱赶装置中的气体,使反应生成的二氧化碳气体被D中碱石灰完全吸收.
装置A能够除去空气中的二氧化碳,氢氧化钠溶液能够吸收二氧化碳.故填:氢氧化钠溶液.
(2)若没有C装置,二氧化碳中的水蒸气也能够被碱石灰吸收,则会导致测定结果偏大.故填:偏大.
(3)E装置的作用是防止空气中的二氧化碳与水蒸气被D中碱石灰吸收使测定结果偏大.故填:防止空气中的二氧化碳与水蒸气被D中碱石灰吸收使测定结果偏大.
(4)解:反应生成二氧化碳的质量为:85.6g-83.4g=2.2g,
设纯碱样品中Na2CO3的质量为x.
Na2CO3+H2SO4═Na2SO4+H2O+CO2↑
106 44
x 2.2g
106:44=x:2.2g
x=5.3g
纯碱样品中碳酸钠的质量分数为: ×100%=88.3%.
×100%=88.3%.
答:纯碱样品中碳酸钠的质量分数为88.3%.
分析:Ⅰ.(1)碳酸氢铵和氯化钠反应能生成氯化铵和碳酸氢钠,碳酸氢钠受热分解能生成碳酸钠、水和二氧化碳;
(2)铵盐和显碱性的物质反应能生成氨气,氯化铵和硝酸银反应能生成氯化银沉淀.
Ⅱ.(1)碱石灰能够吸收二氧化碳和水,氢氧化钠溶液能够吸收空气中的二氧化碳;
(2)浓硫酸能够吸收水;
(3)碱石灰能够吸收空气中的水蒸气和二氧化碳;
(4)根据化学方程式可以进行相关方面的计算.
点评:本题主要考查物质的性质、用途及其化学方程式的书写等方面的知识,书写化学方程式时要注意遵循质量守恒定律.
碳酸氢钠受热分解的化学方程式为:2NaHCO3
 Na2CO3+H2O+CO2↑.
Na2CO3+H2O+CO2↑.(2)氯化铵能和碱反应生成氨气,氨气的化学式是NH3.故填:NH3.
氯化铵能和硝酸银反应生成白色沉淀氯化银,硝酸铵不能和硝酸银反应,可以用硝酸银溶液区别氯化铵和硝酸铵,硝酸银的化学式是AgNO3.故填:AgNO3.
氯化铵中氮元素的质量分数为:
 ×100%=26.2%;
×100%=26.2%;硝酸铵中氮元素的质量分数为:
 ×100%=35%.故填:<.
×100%=35%.故填:<.Ⅱ.(1)鼓入空气的目的是驱赶装置中的气体,使反应生成的二氧化碳气体被D中碱石灰完全吸收.故填:驱赶装置中的气体,使反应生成的二氧化碳气体被D中碱石灰完全吸收.
装置A能够除去空气中的二氧化碳,氢氧化钠溶液能够吸收二氧化碳.故填:氢氧化钠溶液.
(2)若没有C装置,二氧化碳中的水蒸气也能够被碱石灰吸收,则会导致测定结果偏大.故填:偏大.
(3)E装置的作用是防止空气中的二氧化碳与水蒸气被D中碱石灰吸收使测定结果偏大.故填:防止空气中的二氧化碳与水蒸气被D中碱石灰吸收使测定结果偏大.
(4)解:反应生成二氧化碳的质量为:85.6g-83.4g=2.2g,
设纯碱样品中Na2CO3的质量为x.
Na2CO3+H2SO4═Na2SO4+H2O+CO2↑
106 44
x 2.2g
106:44=x:2.2g
x=5.3g
纯碱样品中碳酸钠的质量分数为:
 ×100%=88.3%.
×100%=88.3%.答:纯碱样品中碳酸钠的质量分数为88.3%.
分析:Ⅰ.(1)碳酸氢铵和氯化钠反应能生成氯化铵和碳酸氢钠,碳酸氢钠受热分解能生成碳酸钠、水和二氧化碳;
(2)铵盐和显碱性的物质反应能生成氨气,氯化铵和硝酸银反应能生成氯化银沉淀.
Ⅱ.(1)碱石灰能够吸收二氧化碳和水,氢氧化钠溶液能够吸收空气中的二氧化碳;
(2)浓硫酸能够吸收水;
(3)碱石灰能够吸收空气中的水蒸气和二氧化碳;
(4)根据化学方程式可以进行相关方面的计算.
点评:本题主要考查物质的性质、用途及其化学方程式的书写等方面的知识,书写化学方程式时要注意遵循质量守恒定律.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
追踪科学家的足迹
材料1:纯碱的产量是衡量一个国家化学工业发展水平的重要指标.下面是实验室摸拟侯氏制碱法生产原理的主要过程:
(1)20℃时,向浓氨水中通入足量的二氧化碳得到NH4HCO3饱和溶液;
②向NH4HCO3饱和溶液中加入食盐细粒,并不断搅拌,直到NaHCO3结晶析出完毕;
③将析出的晶体过滤,得到晶体和滤液,洗涤晶体,然后将晶体放在试管中充分加热,得到Na2CO3;
④向③的滤液中加入食盐细粒,析出NH4Cl晶体,过滤,得到NH4Cl.
材料2:四种盐在不同温度下的溶解度表.
试回答下列问题:
(1)在实验室中,你选择的制备C02反应的化学方程式为 .在工业生产中,要获得生产纯碱的原料CO2你认为最经济实用的方法是以 为原料,该反应的化学方程式为 .
(2)有人认为侯氏制碱法有以下优点,你认为其中正确的是 .
A.生产过程中部分反应产物可作为原料循环使用
B.副产品是一种氮肥
C.反应都不需要加热,可节约能源
(3)检验③中的白色粉末中是否含有氯化钠的方法是 .
(4)在②中,随着食盐的逐渐加入,溶液变成了NH4HCO3和NaCl的混合溶液,析出晶体之前,混合溶液中存在的离子有(用离子符号表示,下同.) .在③中,将析出的晶体过滤后,溶液中数量减少的离子有 ;滤液中仍然存在的离子有 .②中反应的化学方程式为 .
(5)在20℃时,向含NH4HC03 21g的饱和溶液中加入足量食盆.试通过计算说明,随着食盐的逐渐加入,为什么会有NaHC03晶体析出,而没有NH4CI晶休析出?理论上能析出多少克NaHCO3?(友情提示:本小题没有计算过程不得分.可能用到的相对分子质量:NH4HC03:79; NaCl:58.5; NaHC03:84,NH4CI:53.5).
材料1:纯碱的产量是衡量一个国家化学工业发展水平的重要指标.下面是实验室摸拟侯氏制碱法生产原理的主要过程:
(1)20℃时,向浓氨水中通入足量的二氧化碳得到NH4HCO3饱和溶液;
②向NH4HCO3饱和溶液中加入食盐细粒,并不断搅拌,直到NaHCO3结晶析出完毕;
③将析出的晶体过滤,得到晶体和滤液,洗涤晶体,然后将晶体放在试管中充分加热,得到Na2CO3;
④向③的滤液中加入食盐细粒,析出NH4Cl晶体,过滤,得到NH4Cl.
材料2:四种盐在不同温度下的溶解度表.
| 温度 盐 溶解度 |
10℃ | 20℃ | 30℃ | 40℃ | 50℃ |
| NaCl | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 |
| NH4HCO3 | 15.8 | 21.0 | 27.0 | ------ | ------ |
| NaHCO3 | 8.1 | 9.6 | 11.1 | 12.7 | ---- |
| NH4Cl | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 |
(1)在实验室中,你选择的制备C02反应的化学方程式为
(2)有人认为侯氏制碱法有以下优点,你认为其中正确的是
A.生产过程中部分反应产物可作为原料循环使用
B.副产品是一种氮肥
C.反应都不需要加热,可节约能源
(3)检验③中的白色粉末中是否含有氯化钠的方法是
(4)在②中,随着食盐的逐渐加入,溶液变成了NH4HCO3和NaCl的混合溶液,析出晶体之前,混合溶液中存在的离子有(用离子符号表示,下同.)
(5)在20℃时,向含NH4HC03 21g的饱和溶液中加入足量食盆.试通过计算说明,随着食盐的逐渐加入,为什么会有NaHC03晶体析出,而没有NH4CI晶休析出?理论上能析出多少克NaHCO3?(友情提示:本小题没有计算过程不得分.可能用到的相对分子质量:NH4HC03:79; NaCl:58.5; NaHC03:84,NH4CI:53.5).
追踪科学家的足迹
材料1:纯碱的产量是衡量一个国家化学工业发展水平的重要指标.下面是实验室摸拟侯氏制碱法生产原理的主要过程:
(1)20℃时,向浓氨水中通入足量的二氧化碳得到NH4HCO3饱和溶液;
②向NH4HCO3饱和溶液中加入食盐细粒,并不断搅拌,直到NaHCO3结晶析出完毕;
③将析出的晶体过滤,得到晶体和滤液,洗涤晶体,然后将晶体放在试管中充分加热,得到Na2CO3;
④向③的滤液中加入食盐细粒,析出NH4CI晶体,过滤,得到NH4CI.
材料2:四种盐在不同温度下的溶解度表.
试回答下列问题:
(1)在实验室中,你选择的制备C02反应的化学方程式为 .在工业生产中,要获得生产纯碱的原料CO2你认为最经济实用的方法是以 为原料,该反应的化学方程式为 .
(2)有人认为侯氏制碱法有以下优点,你认为其中正确的是 .
A.生产过程中部分反应产物可作为原料循环使用
B.副产品是一种氮肥
C.反应都不需要加热,可节约能源
(3)检验③中的白色粉末中是否含有氯化钠的方法是 .
(4)在②中,随着食盐的逐渐加入,溶液变成了NH4HCO3和NaCl的混合溶液,析出晶体之前,混合溶液中存在的离子有(用离子符号表示,下同.) .在③中,将析出的晶体过滤后,溶液中数量减少的离子有 ;滤液中仍然存在的离子有 .②中反应的化学方程式为 .
(5)在20℃时,向含NH4HC0321g的饱和溶液中加入足量食盆.试通过计算说明,随着食盐的逐渐加入,为什么会有NaHC03晶体析出,而没有NH4Cl.
材料1:纯碱的产量是衡量一个国家化学工业发展水平的重要指标.下面是实验室摸拟侯氏制碱法生产原理的主要过程:
(1)20℃时,向浓氨水中通入足量的二氧化碳得到NH4HCO3饱和溶液;
②向NH4HCO3饱和溶液中加入食盐细粒,并不断搅拌,直到NaHCO3结晶析出完毕;
③将析出的晶体过滤,得到晶体和滤液,洗涤晶体,然后将晶体放在试管中充分加热,得到Na2CO3;
④向③的滤液中加入食盐细粒,析出NH4CI晶体,过滤,得到NH4CI.
材料2:四种盐在不同温度下的溶解度表.
| 温度 盐 溶解度 |
10℃ | 20℃ | 30℃ | 40℃ | 50℃ |
| NaCl | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 |
| NH4HCO3 | 15.8 | 21.0 | 27.0 | ------ | ------ |
| NaHCO3 | 8.1 | 9.6 | 11.1 | 12.7 | ---- |
| NH4Cl | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 |
(1)在实验室中,你选择的制备C02反应的化学方程式为
(2)有人认为侯氏制碱法有以下优点,你认为其中正确的是
A.生产过程中部分反应产物可作为原料循环使用
B.副产品是一种氮肥
C.反应都不需要加热,可节约能源
(3)检验③中的白色粉末中是否含有氯化钠的方法是
(4)在②中,随着食盐的逐渐加入,溶液变成了NH4HCO3和NaCl的混合溶液,析出晶体之前,混合溶液中存在的离子有(用离子符号表示,下同.)
(5)在20℃时,向含NH4HC0321g的饱和溶液中加入足量食盆.试通过计算说明,随着食盐的逐渐加入,为什么会有NaHC03晶体析出,而没有NH4Cl.