网址:http://m.1010jiajiao.com/timu3_id_289181[举报]
①NaHS_________________
②NaHPO4_________________
③CH3COONH4_________________
④NaHSO3_________________
⑤NaH2PO4_________________
⑥CuSO4_________________
(2)写出下列各组盐溶液混合后发生反应的离子方程式:
①FeCl3和Na2CO3_________________
②CuSO4和Na2S_________________
③AlCO3和Na2S_________________
④Na2SiO3和NH4Cl_________________
⑤Al2(SO4)3和Na2CO3_________________
⑥Al2(SO4)3和NaHCO3_________________
(1)写出下列物质发生水解反应离子方程式,并指出水溶液酸碱性:
①NaHS
②CuSO4
③CH3COONH4
④NaHSO3
(2)写出下列各组盐溶液混合后发生反应的离子方程式:
①AlCl3和Na2S
②Al2(SO4)3和NaHCO3
(3)溶质的物质的量浓度均为0.2 mol/L的下列八种溶液①HCl ②H2SO4 ③HClO ④Ba(OH)2 ⑤KOH ⑥NaF ⑦KCl ⑧NH4Cl 。这些溶液的pH由小到大的顺序是(填写序号) 。
查看习题详情和答案>>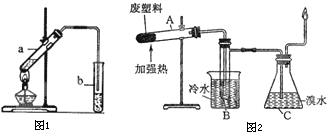
| 实验步骤 | 实验现象 |
| I.向编号为①②③的3支试管中,分别加入1mL 20%的蔗糖溶液,向试管②和③中加入0.5mL稀硫酸,并将这3支试管同时水浴加热约5min | 均无明显现象 |
| II.取试管①和②,加入新制氢氧化铜悬浊液,加热至沸腾 | 均无明显现象 |
| III.取试管③,先加入NaOH溶液调溶液pH至碱性,再加入新制氢氧化铜悬浊液,加热至沸腾 | |
| 结论:证明蔗糖在稀硫酸作用下发生了水解反应 | |
①试管a中生成乙酸乙酯的化学反应方程式是
②试管b中盛放的试剂是
③若要把b中制得的乙酸乙酯从混合物中分离出来,应采用的实验操作是
④生成乙酸乙酯的反应是可逆反应,反应物不能完全变成生成物,反应一段时间后,就达到了该反应的限度,也即达到化学平衡状态.下列描述能说明乙醇与乙酸的酯化反应已达到化学平衡状态的有(填序号)
a单位时间里,生成1mol乙酸乙酯,同时生成1mol水
b单位时间里,生成1mol乙酸乙酯,同时生成1mol乙酸
c单位时间里,消耗1mol乙醇,同时消耗1mol乙酸
d正反应的速率与逆反应的速率相等
e混合物中各物质的浓度不再变化
(3)加热聚丙烯塑料得到的产物如表:
| 产物 | 氢气 | 甲烷 | 乙烯 | 丙烯 | 苯 | 甲苯 | 碳 |
| 质量分数(%) | 12 | 24 | 12 | 16 | 20 | 10 | 6 |
①试管A中的最终残余物为
②试管B收集到的产品中,有能使酸性高锰酸钾溶液褪色的物质,该物质的一氯代物有
③锥形瓶C中观察到的现象是
已知向FeCl3浓溶液中加入Na2CO3浓溶液,可以观察到产生红褐色沉淀和无色气体,写出该反应的离子方程式 。
从形式上看,Na2SO3和Na2CO3相似,那么Na2SO3和FeCl3之间的反应情况又如何呢?某化学研究性学习小组提出了两种可能:一是发生氧化还原反应:2Fe3++SO32-+H2O=2Fe2++SO42-+2H+;二是发生双水解反应:2Fe3++3SO32-+6H2O=3Fe(OH)3(胶体)+3H2SO3; 为了弄清楚发生的是那一种反应发生,同学们设计并实施了下列实验,请填写下列空白:
实验Ⅰ:实验用品 Na2SO3浓溶液、BaCl2稀溶液、稀盐酸、试管若干、胶头滴管若干。从选择的药品分析,实验者设计这个实验的目的是 。
实验Ⅱ:取5mLFeCl3浓溶液于试管中,逐滴加入Na2SO3浓溶液,观察到溶液的颜色由黄色变为红棕色,无气泡产生,无沉淀生成,继续加入Na2SO3浓溶液至过量,溶液的颜色加深,最终变为红褐色。这种红褐色物质是 。向红褐色物质中逐滴加入稀盐酸至过量,可以观察的现象是 。将溶液分成两等份,其中一份加入KSCN溶液,溶液变成血红色,反应的离子方程式为: 。另一份加入BaCl2稀溶液,有少量白色沉淀生成,反应的离子方程式为: 。
实验Ⅲ:换用稀FeCl3和Na2SO3溶液重复实验Ⅱ,产生的现象完全相同。
由上述试验得出的结论是 。
查看习题详情和答案>>
已知向FeCl3浓溶液中加入Na2CO3浓溶液,可以观察到产生红褐色沉淀和无色气体,写出该反应的离子方程式 。
从形式上看,Na2SO3和Na2CO3相似,那么Na2SO3和FeCl3之间的反应情况又如何呢?某化学研究性学习小组提出了两种可能:一是发生氧化还原反应:2Fe3++SO32-+H2O=2Fe2++SO42-+2H+;二是发生双水解反应:2Fe3++3SO32-+6H2O=3Fe(OH)3(胶体)+3H2SO3; 为了弄清楚发生的是那一种反应发生,同学们设计并实施了下列实验,请填写下列空白:
实验Ⅰ:实验用品 Na2SO3浓溶液、BaCl2稀溶液、稀盐酸、试管若干、胶头滴管若干。从选择的药品分析,实验者设计这个实验的目的是 。
实验Ⅱ:取5mLFeCl3浓溶液于试管中,逐滴加入Na2SO3浓溶液,观察到溶液的颜色由黄色变为红棕色,无气泡产生,无沉淀生成,继续加入Na2SO3浓溶液至过量,溶液的颜色加深,最终变为红褐色。这种红褐色物质是 。向红褐色物质中逐滴加入稀盐酸至过量,可以观察的现象是 。将溶液分成两等份,其中一份加入KSCN溶液,溶液变成血红色,反应的离子方程式为: 。另一份加入BaCl2稀溶液,有少量白色沉淀生成,反应的离子方程式为: 。
实验Ⅲ:换用稀FeCl3和Na2SO3溶液重复实验Ⅱ,产生的现象完全相同。
由上述试验得出的结论是 。
查看习题详情和答案>>