摘要:16.下列电负性大小顺序错误的是( ) A. Cu>Ag B. As<P C. Si>C D. Hg>Zn
网址:http://m.1010jiajiao.com/timu3_id_286736[举报]
如图为周期表的一部分,其中的编号代表对应位置的元素.请回答下列问题:

(1)写出表中元素⑨原子的核外电子排布式
(2)元素④、⑤的第一电离能大小顺序是:
(3)元素③、⑧形成的化合物中心原子杂化轨道类型:
(4)已知某些不同族元素的性质也有一定的相似性,如元素②与元素⑦的氢氧化物有相似的性质.写出元素②的氢氧化物与NaOH溶液反应的化学方程式
(5)如图是⑩的某种氧化物的晶胞结构示意图(顶角和体心是氧),可确定该氧化物的化学式为
(6)往硫酸铜溶液中加入过量氨水,可生成[Cu(NH3)4]2+配离子.已知NF3与NH3的结构类似,但NF3 不易与Cu2+形成配离子,其主要原因是:
查看习题详情和答案>>

(1)写出表中元素⑨原子的核外电子排布式
1s22s22p63s23p63d54s1
1s22s22p63s23p63d54s1
.(2)元素④、⑤的第一电离能大小顺序是:
N
N
>O
O
;(用元素符号表示,下同)元素⑥、⑧电负性大小顺序是:F
F
>Cl
Cl
(3)元素③、⑧形成的化合物中心原子杂化轨道类型:
sp3
sp3
,分子的空间构型正四面体
正四面体
(4)已知某些不同族元素的性质也有一定的相似性,如元素②与元素⑦的氢氧化物有相似的性质.写出元素②的氢氧化物与NaOH溶液反应的化学方程式
Be(OH)2+2NaOH═2H2O+Na2BeO2
Be(OH)2+2NaOH═2H2O+Na2BeO2
(5)如图是⑩的某种氧化物的晶胞结构示意图(顶角和体心是氧),可确定该氧化物的化学式为
Cu2O
Cu2O
.(6)往硫酸铜溶液中加入过量氨水,可生成[Cu(NH3)4]2+配离子.已知NF3与NH3的结构类似,但NF3 不易与Cu2+形成配离子,其主要原因是:
NF3分子中氟原子电负性强,吸引孤对电子能力强
NF3分子中氟原子电负性强,吸引孤对电子能力强
.短周期元素X、Y、Z、W、Q在周期表中的相对位置如图所示。下列说法不正确的是
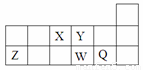
A.离子半径的大小顺序为W>Q>Y>Z
B.X、Y、W三种元素的电负性大小顺序为X>Y>W
C.X、Z、W三种元素的最高价氧化物对应的水化物均能与强碱反应
D.元素X的最简单氢化物与Q的氢化物化合的产物中既含共价键又含离子键
查看习题详情和答案>>
短周期主族元素W、X、Y、Z的原子序数依次增大,W、X原子的最外层电子数之比为4:3,Z原子比X原子的核外电子数多4。下列说法正确的是( )
A.W、Y、Z的电负性大小顺序一定是Z>Y>W
B.W、X、Y、Z的原子半径大小顺序可能是W>X>Y>Z
C.Y、Z形成的分子空间构型可能是正四面体
D.WY2分子中δ键与π键的数目之比是2:1
查看习题详情和答案>>下表为周期表的一部分,其中的编号代表对应位置的元素。
| ① | | | | | | | | | | | | | | | | | |
| | ② | | | | | | | | | | | | ③ | ④ | ⑤ | ⑥ | |
| | | | | | | | | | | | | ⑦ | | | | ⑧ | |
| | | | | | ⑨ | | | | | ⑩ | | | | | | | |
(1)写出上表中元素⑨原子的核外电子排布式 。
(2)元素④、⑤的第一电离能大小顺序是: > ;(用元素符号表示,下同)元素⑥、⑧电负性大小顺序是: >
(3)元素③、⑧形成的化合物中心原子杂化轨道类型: ,分子的空间构型
(4)已知某些不同族元素的性质也有一定的相似性,如元素②与元素⑦的氢
氧化物有相似的性质。写出元素②的氢氧化物与NaOH溶液反应的化学方程式
(5)下图是⑩的某种氧化物的晶胞结构示意图(顶角和体心是氧),可确定该氧化物的化学式为 。

(6)往硫酸铜溶液中加入过量氨水,可生成[Cu(NH3)4]2+配离子。
已知NF3与NH3的结构类似,但NF3不易与Cu2+形成配离子,其主要原因是: 查看习题详情和答案>>