摘要:19.为了测定炭粉与氧化铜的混合物中氧化铜的含量.甲.乙.丙.丁四位同学用该样品进行实验.测得的实验数据如表5-2. (1)混合物中氧化铜的质量分数是 . (2)四位同学中所取稀硫酸不足的是 . (3)求硫酸溶液中的溶质的质量分数 . 表5-2 物质质量 甲 乙 丙 丁 所取混合样品/g 25 25 20 20 加入稀硫酸/g 50 100 100 120 反应后剩余固体/g 21 17 12 12 答案:(1)40% ×100%=40%. (2)甲.乙 (3)9.8% 设硫酸溶液中溶质的质量分数为x CuO+ H2SO4====CuSO4+ H2O 80 98 8 g 100 g·x x=9.8% 知识积累
网址:http://m.1010jiajiao.com/timu3_id_28665[举报]
某课外活动小组加热炭粉(过量)和氧化铜的混合物,再用下图所示装置,对获得的铜粉(含炭)样品进行实验.图中铁架台等装置已略去.请你帮助他们完成下列实验报告.
(1)实验目的:
(2)实验用品:
仪器:天平、分液漏斗、锥形瓶、硬质玻璃管、干燥管、酒精灯、洗气瓶等.
药品:红褐色(含炭)样品、过氧化氢溶液、二氧化锰、碱石灰(固体氢氧化钠和氧化钙的混合物)、浓硫酸等.
(3)实验内容:
(4)计算:样品中铜的质量分数=
×100%
×100%(用含W、m1、m2的代数式表示).
(5)问题和讨论:实验完成后,老师评议说:按上述实验设计,即使C中反应完全,D中吸收完全,也不会得出正确的结果.经讨论,有同学提出在B与C之间加入一个装置.再次实验后,得到了较正确的结果.那么,原来实验所测得的铜的质量分数偏小的原因可能是
查看习题详情和答案>>

(1)实验目的:
测定铜粉样品中铜的质量分数
测定铜粉样品中铜的质量分数
.(2)实验用品:
仪器:天平、分液漏斗、锥形瓶、硬质玻璃管、干燥管、酒精灯、洗气瓶等.
药品:红褐色(含炭)样品、过氧化氢溶液、二氧化锰、碱石灰(固体氢氧化钠和氧化钙的混合物)、浓硫酸等.
(3)实验内容:
| 实验步骤 | 实验现象 | 有关化学方程式 |
| 在C中加入样品粉末W g,D中装入药品后并称量为m1 g,连接好仪器. | ||
| 打开A的上塞、活塞,慢慢滴加溶液. | ||
| 对C进行加热.当C中药品充分反应后,关 闭A的活塞,停止加热. | ||
| 冷却后,称量D的质量为m2 g. |
W-(m2-m1)×
| ||
| W |
W-(m2-m1)×
| ||
| W |
(5)问题和讨论:实验完成后,老师评议说:按上述实验设计,即使C中反应完全,D中吸收完全,也不会得出正确的结果.经讨论,有同学提出在B与C之间加入一个装置.再次实验后,得到了较正确的结果.那么,原来实验所测得的铜的质量分数偏小的原因可能是
水蒸气通过C后被D中碱石灰吸收
水蒸气通过C后被D中碱石灰吸收
.在B与C之间加入的装置可以是洗气瓶
洗气瓶
,其中盛放的药品是浓硫酸
浓硫酸
.
某课外活动小组加热氧化铜和炭粉(过量)的混合物,得到的铜粉中含有炭粉,他们用下图所示的装置,对获得的铜粉样品进行实验分析.以测定样品中铜的质量分数.(图中铁架台等装置已略去.)已知,过氧化氢在二氧化锰的催化作用下分解产生氧气.请你帮他们完成实验报告.
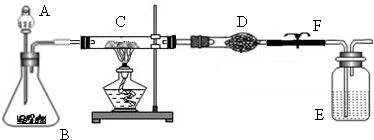
(1)实验过程:
(2)计算:
样品中铜的质量分数= (用含w、m1、m2的代数式表示)
(3)问题和讨论:
实验完成后,老师评议说:按上述实验设计,即使C中反应完全,D中吸收完全,也不会得出正确的结果.经时论,有同学提出在B与C之间加入一个装置.再次实验后.得到了较正确的结果,那么,原来实验所测得的铜的质量分数偏小的原因可能是在B与C之间加入的装置可以是 ;其中盛放的药品是 .
查看习题详情和答案>>

(1)实验过程:
| 编号 | 实验步骤 | 实验现象 | 有关化学方程式 |
| a | 连接好仪器后,打开止水夹F.检查 气密性(观察).在C中加入样品粉末 Wg,在D中装入药品后称量为m1g |
||
| b | 打开A的活塞,慢慢滴加溶液 | ||
| c | 对C进行加热当C中药品充分反应 后,关闭A的活塞、关F,停止加热 |
||
| d | 冷却后,称得D的质量为m2g |
样品中铜的质量分数=
(3)问题和讨论:
实验完成后,老师评议说:按上述实验设计,即使C中反应完全,D中吸收完全,也不会得出正确的结果.经时论,有同学提出在B与C之间加入一个装置.再次实验后.得到了较正确的结果,那么,原来实验所测得的铜的质量分数偏小的原因可能是在B与C之间加入的装置可以是
某课外活动小组加热氧化铜和炭粉(过量)的混合物,得到的铜粉中含有炭粉,他们用下图所示的装置,对获得的铜粉样品进行实验分析.以测定样品中铜的质量分数.(图中铁架台等装置已略去.)已知,过氧化氢在二氧化锰的催化作用下分解产生氧气.请你帮他们完成实验报告.

(1)实验过程:
| 编号 | 实验步骤 | 实验现象 | 有关化学方程式 |
| a | 连接好仪器后,打开止水夹F.检查 气密性(观察).在C中加入样品粉末 Wg,在D中装入药品后称量为m1g | ||
| b | 打开A的活塞,慢慢滴加溶液 | ||
| c | 对C进行加热当C中药品充分反应 后,关闭A的活塞、关F,停止加热 | ||
| d | 冷却后,称得D的质量为m2g |
样品中铜的质量分数=______(用含w、m1、m2的代数式表示)
(3)问题和讨论:
实验完成后,老师评议说:按上述实验设计,即使C中反应完全,D中吸收完全,也不会得出正确的结果.经时论,有同学提出在B与C之间加入一个装置.再次实验后.得到了较正确的结果,那么,原来实验所测得的铜的质量分数偏小的原因可能是在B与C之间加入的装置可以是______;其中盛放的药品是______. 查看习题详情和答案>>
某课外活动小组加热氧化铜和炭粉(过量)的混合物,得到的铜粉中含有炭粉,他们用下图所示的装置,对获得的铜粉样品进行实验分析.以测定样品中铜的质量分数.(图中铁架台等装置已略去.)已知,过氧化氢在二氧化锰的催化作用下分解产生氧气.请你帮他们完成实验报告.

(1)实验过程:
(2)计算:
样品中铜的质量分数=______(用含w、m1、m2的代数式表示)
(3)问题和讨论:
实验完成后,老师评议说:按上述实验设计,即使C中反应完全,D中吸收完全,也不会得出正确的结果.经时论,有同学提出在B与C之间加入一个装置.再次实验后.得到了较正确的结果,那么,原来实验所测得的铜的质量分数偏小的原因可能是在B与C之间加入的装置可以是______;其中盛放的药品是______.
查看习题详情和答案>>

(1)实验过程:
| 编号 | 实验步骤 | 实验现象 | 有关化学方程式 |
| a | 连接好仪器后,打开止水夹F.检查 气密性(观察).在C中加入样品粉末 Wg,在D中装入药品后称量为m1g | ||
| b | 打开A的活塞,慢慢滴加溶液 | ||
| c | 对C进行加热当C中药品充分反应 后,关闭A的活塞、关F,停止加热 | ||
| d | 冷却后,称得D的质量为m2g |
样品中铜的质量分数=______(用含w、m1、m2的代数式表示)
(3)问题和讨论:
实验完成后,老师评议说:按上述实验设计,即使C中反应完全,D中吸收完全,也不会得出正确的结果.经时论,有同学提出在B与C之间加入一个装置.再次实验后.得到了较正确的结果,那么,原来实验所测得的铜的质量分数偏小的原因可能是在B与C之间加入的装置可以是______;其中盛放的药品是______.
查看习题详情和答案>>
某课外活动小组加热氧化铜和炭粉(过量)的混合物,得到的铜粉中含有炭粉,他们用下图所示的装置,对获得的铜粉样品进行实验分析.以测定样品中铜的质量分数.(图中铁架台等装置已略去.)已知,过氧化氢在二氧化锰的催化作用下分解产生氧气.请你帮他们完成实验报告.
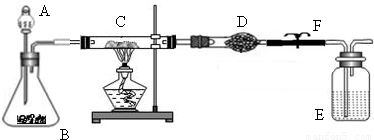
(1)实验过程:
(2)计算:
样品中铜的质量分数=______(用含w、m1、m2的代数式表示)
(3)问题和讨论:
实验完成后,老师评议说:按上述实验设计,即使C中反应完全,D中吸收完全,也不会得出正确的结果.经时论,有同学提出在B与C之间加入一个装置.再次实验后.得到了较正确的结果,那么,原来实验所测得的铜的质量分数偏小的原因可能是在B与C之间加入的装置可以是______;其中盛放的药品是______.
查看习题详情和答案>>

(1)实验过程:
| 编号 | 实验步骤 | 实验现象 | 有关化学方程式 |
| a | 连接好仪器后,打开止水夹F.检查 气密性(观察).在C中加入样品粉末 Wg,在D中装入药品后称量为m1g | ||
| b | 打开A的活塞,慢慢滴加溶液 | ||
| c | 对C进行加热当C中药品充分反应 后,关闭A的活塞、关F,停止加热 | ||
| d | 冷却后,称得D的质量为m2g |
样品中铜的质量分数=______(用含w、m1、m2的代数式表示)
(3)问题和讨论:
实验完成后,老师评议说:按上述实验设计,即使C中反应完全,D中吸收完全,也不会得出正确的结果.经时论,有同学提出在B与C之间加入一个装置.再次实验后.得到了较正确的结果,那么,原来实验所测得的铜的质量分数偏小的原因可能是在B与C之间加入的装置可以是______;其中盛放的药品是______.
查看习题详情和答案>>