网址:http://m.1010jiajiao.com/timu3_id_284400[举报]
下列各反应达到化学平衡后,减小压强或升高温度,Z的物质的量都会增大的是( )
A. ![]()
![]()
![]() (正反应为放热反应)
(正反应为放热反应)
B. ![]()
![]()
![]() (正反应为吸热反应)
(正反应为吸热反应)
C. ![]()
![]()
![]() (正反应为吸热反应)
(正反应为吸热反应)
D. ![]()
![]()
![]() (正反应为吸热反应)
(正反应为吸热反应)

⑴下列能使醋酸溶液中CH3COOH的电离度增大,而电离常数不变的操作是_______(填序号)。
A.升高温度 B.加水稀释 C.加少量的CH3COONa固体 D.加少量冰醋酸
⑵CH3COONH4的水溶液呈______(选填“酸性”、“中性”、“碱性”),理由是____________________。
⑶工业中常将BaSO4转化为BaCO3后,再将其制成各种可溶性的钡盐(如:BaCl2)。具体做法是用饱和的纯碱溶液浸泡BaSO4粉末,并不断补充纯碱,最后BaSO4转化为BaCO3。现有足量的BaSO4悬浊液,在该悬浊液中加纯碱粉末并不断搅拌,为使c(SO42- )达到0.0l mol/L以上,则溶液中c(CO32- )应≥_______ mol/L。
Ⅱ.化学在能源开发与利用中起着重要的作用,如甲醇、乙醇、二甲醚(CH3OCH3)等都是新型燃料。
⑴乙醇是重要的化工产品和液体燃料,可以利用下列反应制取乙醇。
2CO2(g)+6H2(g)
 CH3CH2OH(g)+3H2O(g) △H=a kJ/mol 在一定压强下,测得上述反应的实验数据如下表。
CH3CH2OH(g)+3H2O(g) △H=a kJ/mol 在一定压强下,测得上述反应的实验数据如下表。 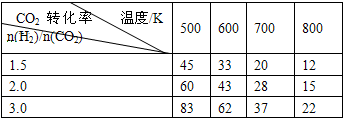
①上述反应的 a_______0(填“大于”或“小于”)。
②在一定温度下,提高氢碳(即n(H2)/n(CO2) )比,平衡常数K值_______(填“增大”、“减小”、或“不变”),对生成乙醇______(填“有利”或“不利”)。
⑵催化剂存在的条件下,在固定容积的密闭容器中投入一定量的CO和H2,同样可制得乙醇(可逆反应)。该反应过程中能量变化如图所示:

②在一定温度下,向上述密闭容器中加入1 mol CO、3 mol H2及固体催化剂,使之反应。平衡时,反应产生的热量为Q kJ,若温度不变的条件下,向上述密闭容器中加入4 mol CO、
12 mol H2及固体催化剂,平衡时,反应产生的热量为w kJ,则w的范围为___________。
⑶二甲醚(CH3OCH3)被称为21世纪的新型燃料,具有清洁、高效的优良性能。以二甲醚、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池,其工作原理与甲烷燃料电池原理相类似。该电池中负极上的电极反应式是_________________。

⑴下列能使醋酸溶液中CH3COOH的电离度增大,而电离常数不变的操作是_______(填序号)。
A.升高温度 B.加水稀释 C.加少量的CH3COONa固体 D.加少量冰醋酸
⑵CH3COONH4的水溶液呈______(选填“酸性”、“中性”、“碱性”),理由是____________________。
⑶工业中常将BaSO4转化为BaCO3后,再将其制成各种可溶性的钡盐(如:BaCl2)。具体做法是用饱和的纯碱溶液浸泡BaSO4粉末,并不断补充纯碱,最后BaSO4转化为BaCO3。现有足量的BaSO4悬浊液,在该悬浊液中加纯碱粉末并不断搅拌,为使c(SO42- )达到0.0l mol/L以上,则溶液中c(CO32- )应≥_______ mol/L。
Ⅱ.化学在能源开发与利用中起着重要的作用,如甲醇、乙醇、二甲醚(CH3OCH3)等都是新型燃料。
⑴乙醇是重要的化工产品和液体燃料,可以利用下列反应制取乙醇。
2CO2(g)+6H2(g)
 CH3CH2OH(g)+3H2O(g) △H=a kJ/mol 在一定压强下,测得上述反应的实验数据如下表。
CH3CH2OH(g)+3H2O(g) △H=a kJ/mol 在一定压强下,测得上述反应的实验数据如下表。 
①上述反应的 a_______0(填“大于”或“小于”)。
②在一定温度下,提高氢碳(即n(H2)/n(CO2) )比,平衡常数K值_______(填“增大”、“减小”、或“不变”),对生成乙醇______(填“有利”或“不利”)。
⑵催化剂存在的条件下,在固定容积的密闭容器中投入一定量的CO和H2,同样可制得乙醇(可逆反应)。该反应过程中能量变化如图所示:

②在一定温度下,向上述密闭容器中加入1 mol CO、3 mol H2及固体催化剂,使之反应。平衡时,反应产生的热量为Q kJ,若温度不变的条件下,向上述密闭容器中加入4 mol CO、
12 mol H2及固体催化剂,平衡时,反应产生的热量为w kJ,则w的范围为___________。
⑶二甲醚(CH3OCH3)被称为21世纪的新型燃料,具有清洁、高效的优良性能。以二甲醚、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池,其工作原理与甲烷燃料电池原理相类似。该电池中负极上的电极反应式是_________________。
(12分)氨是氮循环过程中的重要物质,氨的合成是目前普遍使用的人工固氮方法。
(1)根据图1提供的信息,写出该反应的热化学方程式 ,
在图1中曲线 (填“a” 或“b”)表示加入铁触媒的能量变化曲线。
图1 图2
(2)在恒容容器中,下列描述中能说明上述反应已达平衡的是
A.3v(H2)正=2v(NH3)逆 B.单位时间内生成nmol N2的同时生成2nmolNH3
C.混合气体的密度不再改变 D.容器内压强不随时间的变化而变化
(3)一定温度下,向2L密闭容器中充入1molN2和3molH2,保持体积不变,0.5min后达到平衡,测得容器中有0.4mol NH3,则平均反应速率v(N2)= ,该温度下的平衡常数K= 。若升高温度,K值变化 (填“增大”、“减小”或“不变”)。
(4)为了寻找合成NH3的温度和压强的适宜条件,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中。
| 实验编号 | T(℃) | n (N2)/n(H2) | P(MPa) |
| ⅰ | 450 | 1/3 | 1 |
| ⅱ | _ | _ | 10 |
| ⅲ | 480 | _ | 10 |
B.根据反应N2+ 3H2
 2NH3的特点,在给出的坐标图2中,画出其在1MPa和10MPa条件下H2的转化率随温度变化的趋势曲线示意图,并标明各条曲线的压强。
查看习题详情和答案>>
2NH3的特点,在给出的坐标图2中,画出其在1MPa和10MPa条件下H2的转化率随温度变化的趋势曲线示意图,并标明各条曲线的压强。
查看习题详情和答案>>
(12分)氨是氮循环过程中的重要物质,氨的合成是目前普遍使用的人工固氮方法。
(1)根据图1提供的信息,写出该反应的热化学方程式 ,
在图1中曲线 (填“a” 或“b”)表示加入铁触媒的能量变化曲线。
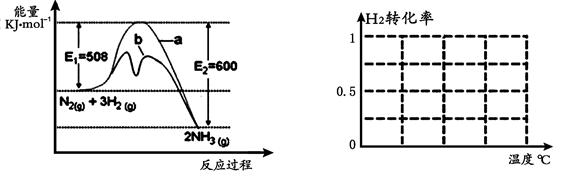
图1 图2
(2)在恒容容器中,下列描述中能说明上述反应已达平衡的是
A.3v(H2)正=2v(NH3)逆 B.单位时间内生成nmol N2的同时生成2nmolNH3
C.混合气体的密度不再改变 D.容器内压强不随时间的变化而变化
(3)一定温度下,向2L密闭容器中充入1molN2和3molH2,保持体积不变,0.5min后达到平衡,测得容器中有0.4mol NH3,则平均反应速率v(N2)= ,该温度下的平衡常数K= 。若升高温度,K值变化 (填“增大”、“减小”或“不变”)。
(4)为了寻找合成NH3的温度和压强的适宜条件,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中。
|
实验编号 |
T(℃) |
n (N2)/n(H2) |
P(MPa) |
|
ⅰ |
450 |
1/3 |
1 |
|
ⅱ |
_ |
_ |
10 |
|
ⅲ |
480 |
_ |
10 |
A.请在上表空格中填入剩余的实验条件数据。
B.根据反应N2+ 3H2 2NH3的特点,在给出的坐标图2中,画出其在1MPa和10MPa条件下H2的转化率随温度变化的趋势曲线示意图,并标明各条曲线的压强。
2NH3的特点,在给出的坐标图2中,画出其在1MPa和10MPa条件下H2的转化率随温度变化的趋势曲线示意图,并标明各条曲线的压强。
查看习题详情和答案>>