��Ŀ����
��12�֣����ǵ�ѭ�������е���Ҫ���ʣ����ĺϳ���Ŀǰ�ձ�ʹ�õ��˹��̵�������
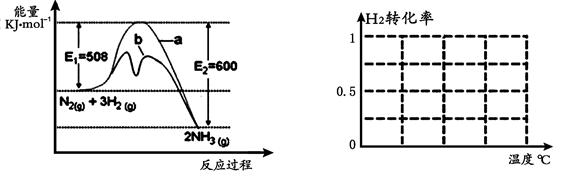
��1������ͼ1�ṩ����Ϣ��д���÷�Ӧ���Ȼ�ѧ����ʽ ��
��ͼ1������ ���a�� ��b������ʾ��������ý�������仯���ߡ�
ͼ1 ͼ2
��2���ں��������У�������������˵��������Ӧ�Ѵ�ƽ�����
A��3v(H2)��=2v(NH3)�� B����λʱ��������nmol N2��ͬʱ����2nmolNH3
C�����������ܶȲ��ٸı� D��������ѹǿ����ʱ��ı仯���仯
��3��һ���¶��£���2L�ܱ������г���1molN2��3molH2������������䣬0.5min��ﵽƽ�⣬�����������0.4mol NH3����ƽ����Ӧ����v(N2)= �����¶��µ�ƽ�ⳣ��K= ���������¶ȣ�Kֵ�仯 �����������С�����䡱����
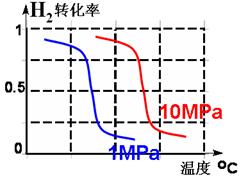
��4��Ϊ��Ѱ�Һϳ�NH3���¶Ⱥ�ѹǿ������������ijͬѧ���������ʵ�飬����ʵ�������Ѿ���������ʵ����Ʊ��С�
|
ʵ���� |
T(��) |
n (N2)/n(H2) |
P(MPa) |
|
�� |
450 |
1/3 |
1 |
|
�� |
_ |
_ |
10 |
|
�� |
480 |
_ |
10 |
A�������ϱ��ո�������ʣ���ʵ���������ݡ�
B�����ݷ�ӦN2+ 3H2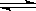 2NH3���ص㣬�ڸ���������ͼ2�У���������1MPa��10MPa������H2��ת�������¶ȱ仯����������ʾ��ͼ���������������ߵ�ѹǿ��
2NH3���ص㣬�ڸ���������ͼ2�У���������1MPa��10MPa������H2��ת�������¶ȱ仯����������ʾ��ͼ���������������ߵ�ѹǿ��
��1��N2(g) + 3H2(g)  2NH3(g) ��H �� -92kJ/mol ��2�֣� b ��1�֣�
2NH3(g) ��H �� -92kJ/mol ��2�֣� b ��1�֣�
��2�� B D ��2�֣�
��3��0.2mol.L-1.min-1�����֣� 0.058�����֣� ��С��1�֣�
��4��(����ȫ���2�֣���ͼ2��)
|
ʵ���� |
T(��) |
n (N2)/n(H2) |
P(MPa) |
|
�� |
|
|
|
|
�� |
_450 |
_ 1/3 |
|
��������
�����������1����ͼ��֪����Ӧ������������������������92KJ������Ϊ���ȷ�Ӧ
N2(g) + 3H2(g) 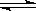 2NH3(g) ��H �� -92kJ/mol
2NH3(g) ��H �� -92kJ/mol
��2��˵����Ӧ�ﵽƽ����������־��V��=V�������߷�Ӧ��ϵ�ڸ�����Ũ�Ȳ��ٷ����ı䣬�ʴ�ΪBD
��3��N2(g) + 3H2(g) 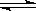 2NH3(g)
2NH3(g)
C0 0.5 1.5 0
��C 0.1 0.3 0.2
Ct 0.4 1.2 0.2
V��N2��=��C��N2����t=0.2mol.L-1.min-1 ƽ�ⳣ��K=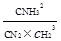 =0.058
=0.058
��4��A���Ʊ�������ÿ����ʵ��Ӧ��ֻ��һ����������n (N2)/n(H2)Ӧ�㶨����
B��ӦΪ���ȷ�Ӧ�������¶�Խ��H2��ת����Խ�ͣ���Ӧ�������������С�ķ�Ӧ��ѹǿԽ��H2��ת����Խ��
���㣺��ѧ��Ӧ�������仯����ѧ��Ӧ���ʵļ��㡢��ѧƽ���Ӱ������
���������⿼���֪ʶ��϶࣬ͼ�������۵Ľ�����ص㡣��ͼ���ҳ�������Ϣ�Խ������Ҫ������ѧ�����ۺ��������ѶȽϴ�

 ��У������Ԫͬ��ѵ��������ϵ�д�
��У������Ԫͬ��ѵ��������ϵ�д�
