网址:http://m.1010jiajiao.com/timu3_id_282692[举报]
铁和铝是两种重要的金属,它们的单质及其化合物有着各自的性质。
(1)现配制100mL 0.01mol∙L-1 FeCl3溶液,配制过程中需要的玻璃仪器除量筒、胶头滴管、烧杯外,还需要 ,配制过程中除需用FeCl3固体、蒸馏水外,还需要的试剂有 。将已配制好的溶液滴入沸水中并煮沸一段时间,可得到红褐色液体,该反应的离子方程式为 ,此液体具有的性质是 (填字母)。
a.光束通过该液体时形成光亮的“通路”
b.向该液体中加入AgNO3溶液,无沉淀产生
c.将该液体进行过滤,可得到红褐色固体
d.将该液体加热、蒸干、灼烧后,有氧化物生成
(2)在隔绝空气的条件下,用镁条引燃Fe3O4粉末和铝粉的均匀混合物,使其充分反应。
①向充分反应后的剩余固体中加入足量的NaOH溶液,有大量气泡产生,所得剩余固体中除铁外还含有的固体物质是 (填化学式)。
②已知:3Fe(s)+2O2(g)=Fe3O4(s) △H=−1118 kJ·mol-1
2Al(s)+3/2O2(g)=Al2O3(s) △H=−1675.7 kJ·mol-1
则铝与Fe3O4发生反应生成铁和Al2O3的热化学方程式为
。
查看习题详情和答案>>
(10分)
(1)经测定,20g氢气在氧气中燃烧生成水蒸气,放热2418.0kJ,写出该反应的热化学方程式 ;
已知:3Fe (s)+2O2(g)== Fe3O4(s) △H=-1118.4kJ• mol—1,根据以上信息,则反应 3Fe(s)+4H2O(g)==Fe3O4(s)+4H2(g) 的△H= ,该反应达平衡时,化学平衡常数表达式K= 。
(2)某学生实验小组用50mL0.50mol•L—1的盐酸与50mL0.50mol•L—1的NaOH溶液在下图所示的装置中进行中和反应反应热的测定

①图中装置缺少的一种仪器,该仪器名称为 。
②将反应混合液的 温度记为反应的终止温度。
③下列说法正确的是
A.小烧杯内残留有水,会使测得的反应热数值偏小
B.酸、碱混合时,应把量筒中的溶液缓缓倒入烧杯的溶液中,以防液体外溅
C.烧杯间填满碎纸条的作用是固定小烧杯
D.可用相同浓度和体积的醋酸代替稀盐酸溶液进行实验
查看习题详情和答案>>
铁元素是重要的金属元素,单质铁在工业和生活中使用得最为广泛。铁还有很多重要的化合物及其化学反应。如铁与水反应:3Fe(s)+4H2O(g)=Fe3O4(s)+4H2(g) △H
(1)上述反应的平衡常数表达式K=_______。
(2) 已知:①3Fe(s)+2O2(g)=Fe3O4(s) △H1=-1118.4kJ/mol
②2H2(g)+O2(g)=2H2O(g) △H2=-483.8kJ/mol
③2H2(g)+O2(g)=2H2O(l) △H3=-571.8kJ/mol
则△H=_______。
(3)在t0C时,该反应的平衡常数K=16,在2L恒温恒容密闭容器甲和乙中,分别按下表所示加入物质,反应经过一段时间后达到平衡。
|
|
Fe |
H2O(g) |
Fe3O4 |
H2 |
|
甲/mol |
1.0 |
1.0 |
1.0 |
1.0 |
|
乙/mol |
1.0 |
1.5 |
1.0 |
1.0 |
①甲容器中H2O的平衡转化率为_______ (结果保留一位小数)。
②下列说法正确的是_______ (填编号)
A.若容器压强恒定,则反应达到平衡状态
B.若容器内气体密度恒定,则反应达到平衡状态
C.甲容器中H2O的平衡转化率大于乙容器中H2O的平衡转化率
D.增加Fe3O4就能提高H2O的转化率
(4)若将(3)中装置改为恒容绝热(不与外界交换能量)装置,按下表充入起始物质,起始时与平衡后的各物质的量见表:
|
|
Fe |
H2O(g) |
Fe3O4 |
H2 |
|
起始/mol |
3.0 |
4.0 |
0 |
0 |
|
平衡/mol |
m |
n |
p |
q |
若在达平衡后的装置中继续加入A、B、C三种状况下的各物质,见表:
|
|
Fe |
H2O(g) |
Fe3O4 |
H2 |
|
A/mol |
3.0 |
4.0 |
0 |
0 |
|
B/mol |
0 |
0 |
1 |
4 |
|
C/mol |
m |
n |
p |
q |
当上述可逆反应再一次达到平衡状态后,上述各装置中H2的百分含量按由大到小的顺序排列的关系是
________(用A、B、C表示)。
(5)已知Fe(OH)3的Ksp=2.79×10-39,而FeCl3溶液总是显示较强的酸性,若某FeCl3溶液的pH为3,则该溶液中c(Fe3+)=________mol • L-1 (结果保留3位有效数字)
查看习题详情和答案>>
经测定,
20 g氢气在氧气中燃烧生成水蒸气,放热2418.0 kJ,写出该反应的热化学方程式________;已知:3Fe(s)+2O2(g)![]() Fe3O4(s) ΔH=-1118.4 kJ·mol-1,
Fe3O4(s) ΔH=-1118.4 kJ·mol-1,
26
(1)经测定,20g氢气在氧气中燃烧生成水蒸气,放热2418.0kJ,写出该反应的热化学方程式 ;
已知:3Fe (s)+2O2(g)== Fe3O4(s) △H=-1118.4kJ?? mol—1,根据以上信息,则反应 3Fe(s)+4H2O(g)==Fe3O4(s)+4H2(g) 的△H= ,该反应达平衡时,化学平衡常数表达式K= 。
(2)某学生实验小组用50mL0.50mol??L—1的盐酸与50mL0.50mol??L—1的NaOH溶液在下图所示的装置中进行中和反应反应热的测定![]()
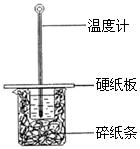
①图中装置缺少的一种仪器,该仪器名称为 。
②将反应混合液的 温度记为反应的终止温度。
③下列说法正确的是
A.小烧杯内残留有水,会使测得的反应热数值偏小
B.酸、碱混合时,应把量筒中的溶液缓缓倒入烧杯的溶液中,以防液体外溅
C.烧杯间填满碎纸条的作用是固定小烧杯
D.可用相同浓度和体积的醋酸代替稀盐酸溶液进行实验
查看习题详情和答案>>