摘要:25.在100℃和200kPa的条件下.反应aA(g)bB建立平衡后.在不加入任何物质的条件下逐步增大体系的压强.F表列出的不同压强下反应建立平衡时物质B的浓度. 压强(kPa) 200 500 1000 B的浓度 0.04 0.1 0.27 根据表中的数据.回答下列问题: (1)压强从200kPa增加到500kPa时.平衡 移动(填“正向 或“逆向 或“不 ). (2)压强从500kPa增加到1000kPa时.平衡 移动(填“正向 或“逆向 或 “不 ).其原因可能为 .
网址:http://m.1010jiajiao.com/timu3_id_281785[举报]
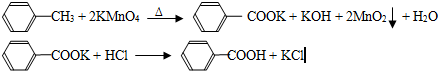
苯甲酸广泛应用于制药和化工行业,用甲苯的氧化反应制备苯甲酸.反应原理:
C6H5CH3+2KMnO4
C6H5COOK+KOH+2MnO2↓+H2O
C6H5COOK+HCl→C6H5COOH+KCl
实验方法:一定量的甲苯和KMnO4溶液在100℃反应一段时间后停止反应,按如下流程分离出苯甲酸和回收未反应的甲苯.
已知:苯甲酸相对分子质量122,熔点122.4℃,在25℃和95℃时溶解度分别为3g和6.9g;纯净固体有机物一般都有固定熔点.
(1)操作Ⅰ用到的主要实验仪器为
(2)无色液体A是
(3)测定白色固体B的熔点,发现达到130℃时仍有少量不熔.则白色固体B是
(4)纯度测定:称取1.220g产品,配成100mL溶液,移取25.00mL溶液,用KOH溶液发生中和反应,消耗KOH的物质的量为2.40×10-3 mol.产品中苯甲酸质量分数为
查看习题详情和答案>>
C6H5CH3+2KMnO4
| △ |
C6H5COOK+HCl→C6H5COOH+KCl
实验方法:一定量的甲苯和KMnO4溶液在100℃反应一段时间后停止反应,按如下流程分离出苯甲酸和回收未反应的甲苯.
已知:苯甲酸相对分子质量122,熔点122.4℃,在25℃和95℃时溶解度分别为3g和6.9g;纯净固体有机物一般都有固定熔点.
(1)操作Ⅰ用到的主要实验仪器为
分液
分液
,操作Ⅱ的名称为蒸馏
蒸馏
.
(2)无色液体A是
甲苯
甲苯
,定性检验A的试剂是酸性KMnO4溶液
酸性KMnO4溶液
.(3)测定白色固体B的熔点,发现达到130℃时仍有少量不熔.则白色固体B是
苯甲酸与KCl
苯甲酸与KCl
.(4)纯度测定:称取1.220g产品,配成100mL溶液,移取25.00mL溶液,用KOH溶液发生中和反应,消耗KOH的物质的量为2.40×10-3 mol.产品中苯甲酸质量分数为
96%
96%
(保留二位有效数字).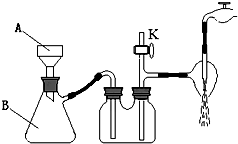 高氯酸钾广泛用于火箭及热电池业.实验室制取高氯酸钾的原理与苏教版《实验化学》中“硝酸钾晶体的制备”相同,步骤为:称取一定质量的KCl、NaClO4加热溶解,经冷却结晶、过滤、滤出晶体用蒸馏水多次洗涤及真空干燥得到.
高氯酸钾广泛用于火箭及热电池业.实验室制取高氯酸钾的原理与苏教版《实验化学》中“硝酸钾晶体的制备”相同,步骤为:称取一定质量的KCl、NaClO4加热溶解,经冷却结晶、过滤、滤出晶体用蒸馏水多次洗涤及真空干燥得到.(1)写出实验室制取高氯酸钾的化学方程式:
(2)用蒸馏水多次洗涤晶体的目的是
(3)称取29.8gKCl和34.0gNaNO3放入250mL烧杯中,再加入70.0g蒸馏水,制备KNO3晶体,I,使固体全部溶解.II,在100°C时蒸发掉50.0g水,维持该温度,趁热过滤析出晶体m1g.III,冷却结晶:待滤液冷却至室温(实验时室温为10°C)后,进行减压过滤.得KNO3粗产品m2g.IV,重结晶得KNO3纯品m3g.
查阅资料:文献中查得,四种盐在不同温度下的溶解度(S/g)如下表:
| NaNO3 | KNO3 | NaCl | KCl | |
| 10°C | 80.5 | 20.9 | 35.7 | 31.0 |
| 100°C | 175 | 246 | 39.1 | 56.6 |
②该装置有三处错误,分别是
③若实验过程中发现倒吸现象,应采取的措施是
(4)KNO3晶体纯品的产率
(2012?广东)苯甲酸广泛应用于制药和化工行业,某同学尝试用甲苯的氧化反应制备苯甲酸,反应原理:
实验方法:一定量的甲苯和KMnO4溶液在100℃反应一段时间后停止反应,按如下流程分离出苯甲酸和回收未反应的甲苯.

已知:苯甲酸分子量122,熔点122.4℃,在25℃和95℃时溶解度分别为0.3g和6.9g;纯净固体有机物都有固定熔点.
(1)操作Ⅰ为
(2)无色液体A是
(3)测定白色固体B的熔点,发现其在115℃开始熔化,达到130℃时仍有少量不熔,该同学推测白色固体B是苯甲酸与KCl的混合物,设计了如下方案进行提纯和检验,实验结果表明推测正确.请在答题卡上完成表中内容.
(4)纯度测定:称取1.220g产品,配成100ml甲醇溶液,移取25.00ml溶液,滴定,消耗KOH的物质的量为2.40×10-3mol,产品中苯甲酸质量分数的计算表达式为
×100%;
×100%;,计算结果为
查看习题详情和答案>>

实验方法:一定量的甲苯和KMnO4溶液在100℃反应一段时间后停止反应,按如下流程分离出苯甲酸和回收未反应的甲苯.

已知:苯甲酸分子量122,熔点122.4℃,在25℃和95℃时溶解度分别为0.3g和6.9g;纯净固体有机物都有固定熔点.
(1)操作Ⅰ为
分液
分液
,操作Ⅱ为蒸馏
蒸馏
.(2)无色液体A是
甲苯
甲苯
,定性检验A的试剂是酸性KMnO4溶液
酸性KMnO4溶液
,现象是紫色溶液褪色
紫色溶液褪色
删去此空
删去此空
.(3)测定白色固体B的熔点,发现其在115℃开始熔化,达到130℃时仍有少量不熔,该同学推测白色固体B是苯甲酸与KCl的混合物,设计了如下方案进行提纯和检验,实验结果表明推测正确.请在答题卡上完成表中内容.
| 序号 | 实验方案 | 实验现象 | 结论 |
| ① | 将白色固体B加入水中,加热溶解, 冷却 冷却 过滤 过滤 |
得到白色晶体和无色溶液 | |
| ② | 取少量滤液于试管中, 滴入适量的硝酸酸化的AgNO3溶液 滴入适量的硝酸酸化的AgNO3溶液 |
生成白色沉淀 | 滤液含Cl- |
| ③ | 干燥白色晶体, 加热使其融化,测其熔点 加热使其融化,测其熔点 |
熔点为122.4℃ 熔点为122.4℃ |
白色晶体是苯甲酸 |
| 2.4×10-3mol×4×122g/mol |
| 1.22g |
| 2.4×10-3mol×4×122g/mol |
| 1.22g |
96%
96%
(保留二位有效数字).下面是四种盐在不同温度下的溶解度(克/100克水)
(计算时假定:①盐类共存时不影响各自的溶解度;②过滤晶体时,溶剂损耗忽略不计.)
(1)取23.4克NaCl和40.4克KNO3,加70.0克H2O,加热溶解.在100℃时蒸发掉50.0克H2O,维持该温度,过滤出晶体,计算所得晶体的质量(m高温).将滤液冷却至10℃,待充分结晶后,过滤.计算所得晶体的质量(m低温).
(2)另取34.0克NaNO3和29.8克KCl,同样进行如上实验.10℃时析出的晶体是
查看习题详情和答案>>
| NaNO3 | KNO3 | NaCl | KCl | |
| 10℃ | 80.5 | 20.9 | 35.7 | 31.0 |
| 100℃ | 175 | 246 | 39.1 | 56.6 |
(1)取23.4克NaCl和40.4克KNO3,加70.0克H2O,加热溶解.在100℃时蒸发掉50.0克H2O,维持该温度,过滤出晶体,计算所得晶体的质量(m高温).将滤液冷却至10℃,待充分结晶后,过滤.计算所得晶体的质量(m低温).
(2)另取34.0克NaNO3和29.8克KCl,同样进行如上实验.10℃时析出的晶体是
KNO3和NaCl
KNO3和NaCl
(写化学式).100℃和10℃得到的晶体质量(m′高温和m′低温)分别是多少?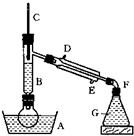 溴乙烷的沸点是38.4℃,密度是1.46g/cm3.如图为实验室制备溴乙烷的装置示意图(夹持仪器已略去).A-水浴加热装置,B-分馏柱,C-温度计,F-接液管,G-中盛蒸馏水.在圆底烧瓶中依次加入溴化钠、适量水、95%乙醇和浓H2SO4.边反应边蒸馏,蒸出的溴乙烷用水下收集法获得.可能发生的副反应:H2SO4(浓)+2HBr=Br2+SO2+2H2O
溴乙烷的沸点是38.4℃,密度是1.46g/cm3.如图为实验室制备溴乙烷的装置示意图(夹持仪器已略去).A-水浴加热装置,B-分馏柱,C-温度计,F-接液管,G-中盛蒸馏水.在圆底烧瓶中依次加入溴化钠、适量水、95%乙醇和浓H2SO4.边反应边蒸馏,蒸出的溴乙烷用水下收集法获得.可能发生的副反应:H2SO4(浓)+2HBr=Br2+SO2+2H2O(1)反应中要加入适量水不能产生的作用是
c
c
a.减少副反应的发生 b.减少HBr的挥发
c.使反应混合物分层 d.溶解NaBr
(2)反应采用水浴加热是为了:①反应容器受热均匀,②
控制反应温度在100℃以内
控制反应温度在100℃以内
.温度计显示的温度最好控制在
38.4
38.4
℃,这是因为溴乙烷的沸点是38.4℃,该温度下只有溴乙烷蒸馏出来
溴乙烷的沸点是38.4℃,该温度下只有溴乙烷蒸馏出来
.(3)分馏柱的作用是:①使溴乙烷馏出;②
冷凝回流乙醇和水
冷凝回流乙醇和水
.(4)反应采取边反应边蒸馏的操作设计,主要是为
蒸馏能及时分离出生成物,促进平衡向右移动
蒸馏能及时分离出生成物,促进平衡向右移动
.(5)溴乙烷可用水下收集法获得的根据是
不溶于水
不溶于水
、密度比水大
密度比水大
,接液管口恰好没入液面的理由是防止蒸气逸出
防止蒸气逸出
、防止倒吸
防止倒吸
.(6)粗产品用水洗涤后有机层仍呈红棕色,欲除去该杂质,可加入的试剂为
b
b
.a.碘化钾溶液 b.亚硫酸氢钠溶液 c.氢氧化钠浓溶液
(7)写出制备溴乙烷的总反应方程式:
C2H5OH+NaBr+H2SO4
C2H5Br+NaHSO4+H2O
| △ |
C2H5OH+NaBr+H2SO4
C2H5Br+NaHSO4+H2O
.| △ |