网址:http://m.1010jiajiao.com/timu3_id_281707[举报]
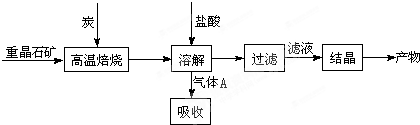
某研究小组在实验室用重晶石(主要成分BaSO4)对工业过程进行模拟实验.
查表得:BaSO4(s)+4C(s)
| 高温 |
BaSO4(s)+2C(s)
| 高温 |
(1)①制备BaCl2的工艺流程图中气体A用过量NaOH溶液吸收,得到硫化钠.Na2S水解的离子方程式为:
②常温下,相同浓度的Na2S和NaHS溶液中,下列说法正确的是:
A.Na2S溶液的pH比NaHS溶液pH大
B.两溶液中含有的离子种类不同
C.两溶液中滴入同体积同浓度的盐酸,产生气体速率相等
D.两溶液中加入NaOH固体,c(S2-)都增大
E.NaHS溶液中:c(Na+)>c(HS-)>c(OH-)>c (H+)>c(S2-)
(2)向BaCl2溶液中加入AgNO3和KBr,当两种沉淀共存时,
| c(Br-) |
| c(Cr-) |
[已知:Ksp(AgBr)=5.4×10-13,Ksp(AgCl)=2.0×10-10]
(3)反应C(s)+CO2(g)
| 高温 |
(4)实际生产中必须加入过量的炭,同时还要通入空气,其目的是:①
试回答下列问题
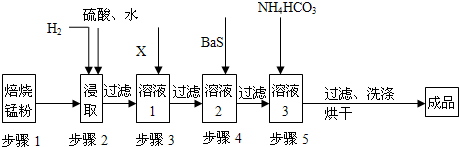
(1)锰在元素周期表中第
(2)步骤1和步骤2是将MnO2等转化为MnO并溶于硫酸,其中步骤2中的氢气,是另一个流程产生的副产品,请写出产生氢气的反应方程式
(3)步骤3和步骤4都是除杂质
①X是一种“绿色”氧化剂,则X是
②步骤3是除去杂质Fe2+.请用文字和必要的方程式简述除去Fe2+的方法 (已知三种离子沉淀的pH范围为Fe3+:2.7~3.7,Mn2+:8.6~10.1,Fe2+:7.6~9.6.)
③步骤4中主要反应方程式为:MeSO4+BaS=MeS↓+BaSO4↓(Me主要为Pb、Cd、Hg等),则其除去杂质的原理是
(4)已知进行步骤5的操作时,溶液3(主要成分为MnSO4)会产生大量无色无味的气泡,则步骤5反应的化学方程式为
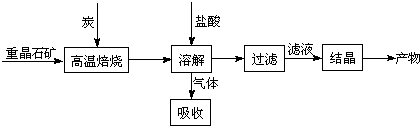
某研究小组在实验室用重晶石(主要成分BaSO4)对工业过程进行模拟实验.查表得
BaSO4(s)+4C(s)
| 高温 |
BaSO4(s)+2C(s)
| 高温 |
(1)气体用过量NaOH溶液吸收,得到硫化钠.Na2S水解的离子方程式为
(2)反应C(s)+CO2(g)
| 高温 |
(3)“温室效应”是全球关注的环境问题之一.CO2是目前大气中含量最高的一种温室气体.因此,控制和治理CO2是解决温室效应的有效途径.
①下列措施中,有利于降低大气中CO2浓度的有:
a.减少化石燃料的使用 b.植树造林,增大植被面积
c.采用节能技术 d.利用太阳能、风能
②将CO2转化成有机物可有效实现碳循环.CO2转化成有机物的例子很多,如:
a.6CO2+6H2O
| 光合作用 |
| 催化剂 |
| △ |
c.CO2+CH4
| ||
| △ |
| ||
| △ |
以上反应中,最节能的是
(10分)工业上利用含锰废水(主要含MnSO4、H2SO4、和铁、铝、铜等金属的硫酸盐)制取碳酸锰(MnCO3)。步骤如下:
Ⅰ.氧化:向废水中加入氧化剂;
Ⅱ.中和:控制温度在40~50 ℃,加入氨水,过滤;
Ⅲ.除重金属:向滤液中加入BaS溶液,除去Cu2+ 等重金属,过滤,得MnSO4溶液;
Ⅳ.制固体MnSO4:从MnSO4溶液得其固体;
Ⅴ.制MnCO3:用水溶解MnSO4固体,加入NH4HCO3溶液,得MnCO3沉淀粗品;
Ⅵ.洗涤:用水洗涤MnCO3粗品至无SO42-,获得高纯MnCO3。
回答下列问题:
(1)Ⅰ中,下列氧化剂均能把Fe2+氧化为Fe3+,最佳的试剂是_____。
a.浓HNO3 b.MnO2 c.K2Cr2O7
(2)Ⅱ中,氨水除中和酸外,同时沉淀Fe3+、Al3+ 等,沉淀Al3+的离子方程式是:
______________________________________________________。
(3)Ⅳ中,溶液需浓缩、结晶、_______(填一种分离操作的名称),得MnSO4固体。
(4)Ⅴ中生成MnCO3沉淀的离子方程式是:
______________________________________________________。
(5)由MnCO3 可制得重要的催化剂MnO2,MnCO3 → MnO2+ CO。
现加热分解 460.0 kg的MnCO3,得到332.0 kg产品,若产品中杂质只有MnO,则该产品中MnO2的质量是 kg。(摩尔质量/g·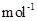 :MnCO3 115 MnO2 87 MnO 71)
:MnCO3 115 MnO2 87 MnO 71)
查看习题详情和答案>>
已知:BaSO4(s) + 4C(s) 4CO(g) + BaS(s)工业上以重晶石矿(主要成分BaSO4,杂质为Fe2O3、SiO2)为原料,通过下列流程生产氯化钡晶体(BaCl2·nH2O)。
4CO(g) + BaS(s)工业上以重晶石矿(主要成分BaSO4,杂质为Fe2O3、SiO2)为原料,通过下列流程生产氯化钡晶体(BaCl2·nH2O)。

回答下列问题:
(1)不溶物A的化学式是_________;若在实验室进行焙烧时,所产生的气体的处理方法是
a.用NaOH溶液吸收 b.用浓硫酸吸收 c.点燃
(2)用单位体积溶液中所含的溶质质量数来表示的浓度叫质量-体积浓度,可以用g/L表示,现用38%的浓盐酸配制含溶质109.5g/L的稀盐酸500mL,所需要的玻璃仪器除了玻璃棒还有 。
(3)沉淀反应中所加的试剂R可以是下列试剂中的
a.NaOH溶液 b.BaO固体 c.氨水 d.生石灰
证明沉淀已经完全的方法是________________________________________________________。
(4)设计一个实验确定产品氯化钡晶体(BaCl2·nH2O)中的n值,完善下列实验步骤:
①称量样品②_______ ③置于_________(填仪器名称)中冷却 ④称量 ⑤恒重操作。
恒重操作是指____________________________________________ _;
第③步物品之所以放在该仪器中进行实验的原因是 。
(5)将重晶石矿与碳以及氯化钙共同焙烧,可以直接得到氯化钡,该反应的化学方程为
BaSO4+ 4C+CaCl2 4CO + CaS+ BaCl2。请你完善下列从焙烧后的固体中分离得到氯化钡晶体的实验流程的设计(已知硫化钙不溶于水,易溶于盐酸)。
4CO + CaS+ BaCl2。请你完善下列从焙烧后的固体中分离得到氯化钡晶体的实验流程的设计(已知硫化钙不溶于水,易溶于盐酸)。
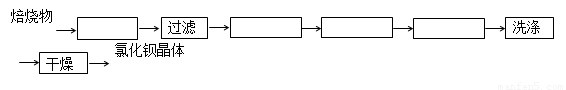
(方框内填写操作名称)
查看习题详情和答案>>