摘要:22.下图为氢氧燃料电池的示意图: (I)若以稀硫酸为电解液.则a极为 极. (2)若以KOH溶液作电解液.则b极上的电极反应式为 . 放电一段时间后电解液的pH将 (填“变人 .“变小 或“不变 ).
网址:http://m.1010jiajiao.com/timu3_id_281604[举报]
氢氧燃料电池是符合绿色化学理念的新型发电装置。下图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定。请回答
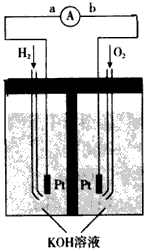
(1)氢氧燃料电池的能量转化主要形式是________,在导线中电子流动方向为________(用a、b表示)。
(2)负极反应式为__________________。
(3)电极表面镀铂粉的原因为____________________。
(4)该电池工作时,H2和O2连续由外部供给,电池可连续不断提供电能。因此,大量安全储氢是关键技术之一。金属锂是一种重要的储氢材料,吸氢和放氢原理如下:
I.2Li+H2 2LiH Ⅱ.LiH+H2O=LiOH+H2↑
2LiH Ⅱ.LiH+H2O=LiOH+H2↑
①反应I中的还原剂是________,反应Ⅱ中的氧化剂是________
②已知LiH固体密度为0.82 g/cm3,用锂吸收224 L(标准状况)H2,生成的LiH体积与被吸收的H2体积比为
________
③由②生成的LiH与H2O作用,放出的H2用作电池燃料,若能量转化率为80%,则导线中通过电子的物质的量为________mol。
查看习题详情和答案>>
(2)负极反应式为__________________。
(3)电极表面镀铂粉的原因为____________________。
(4)该电池工作时,H2和O2连续由外部供给,电池可连续不断提供电能。因此,大量安全储氢是关键技术之一。金属锂是一种重要的储氢材料,吸氢和放氢原理如下:
I.2Li+H2
 2LiH Ⅱ.LiH+H2O=LiOH+H2↑
2LiH Ⅱ.LiH+H2O=LiOH+H2↑①反应I中的还原剂是________,反应Ⅱ中的氧化剂是________
②已知LiH固体密度为0.82 g/cm3,用锂吸收224 L(标准状况)H2,生成的LiH体积与被吸收的H2体积比为
________
③由②生成的LiH与H2O作用,放出的H2用作电池燃料,若能量转化率为80%,则导线中通过电子的物质的量为________mol。
绿色、低碳、环保新能源是当今经济社会关注的热点.
I.如图是太阳光伏电池光电转换系统示意图,由图判断:
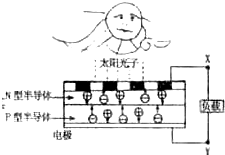
N型半导体是电池的 极;电流由极流向 极(填X、Y)
Ⅱ.下列观点符合科学道理的有: ;
A.核电站能把化学能转化为电能,应大力发展核能;
B.太阳光伏电池是把光能转换成电能的装置,其工作原理与原电池工作原理相同;
C.大量使用锂电池是开发环保新能源的举措;
D.氢氧燃料电池是一种绿色、环保、低碳的新能源;
Ⅲ.2010年全球锂离子电池总产量超过38亿只,回收废旧锂离子电池意义重大,其中需要重点回收利用的是正极材料,其主要成份有LiCoO2(钴酸锂),炭黑,铝箔等,某种回收流程如下:
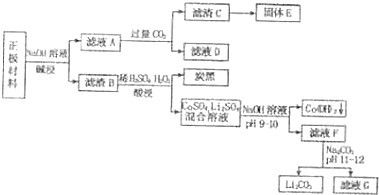
(1)碱浸时,正极材料中 溶解(填名称)发生反应的化学方程式: ;
(2)写出滤液A中通入过量CO2的离子方程式: ;D溶液呈 (填“酸性”、“碱性”或“中性”),原因是(用离子方程式表示): .
(3)酸浸发生反应的化学方程式是: ;该反应若转移0.5mole-,则在标准状况下产生O2体积为 L.
查看习题详情和答案>>
I.如图是太阳光伏电池光电转换系统示意图,由图判断:

N型半导体是电池的
Ⅱ.下列观点符合科学道理的有:
A.核电站能把化学能转化为电能,应大力发展核能;
B.太阳光伏电池是把光能转换成电能的装置,其工作原理与原电池工作原理相同;
C.大量使用锂电池是开发环保新能源的举措;
D.氢氧燃料电池是一种绿色、环保、低碳的新能源;
Ⅲ.2010年全球锂离子电池总产量超过38亿只,回收废旧锂离子电池意义重大,其中需要重点回收利用的是正极材料,其主要成份有LiCoO2(钴酸锂),炭黑,铝箔等,某种回收流程如下:

(1)碱浸时,正极材料中
(2)写出滤液A中通入过量CO2的离子方程式:
(3)酸浸发生反应的化学方程式是:
随着环保意识的增强,清洁能源越来越受人们关注.
(1)氢能在二十一世纪有可能在世界能源舞台上成为一种举足轻重的二次能源.
①硫-碘循环分解水制氢主要涉及下列反应:
I.SO2+2H2O+I2=H2SO4+2HIⅡ.2HI
H2+I2Ⅲ.2H2SO4=2SO2+O2+2H2O
分析上述反应,下列判断正确的是
a.反应Ⅲ易在常温下进行 b.反应I中SO2氧化性比HI强
c.循环过程中需补充H2O d.循环过程中产生l mol O2的同时产生1mol H2
②利用甲烷与水反应制备氢气,因原料价廉产氢率高,具有实用推广价值,已知该反应为:CH4(g)+H2O(g)=CO(g)+3H2(g)△H=+206.1kJ?mol-1若800℃时,反应的平衡常数K1=1.0,某时刻测得该温度下,密闭容器中各物质的物质的量浓度分别为:c(CH4)=3.0mol?L-1;c(H2O)=8.5mol?L-1;c(CO)=2.0mol?L-1;c(H2)=2.0mol?L-1,则此时正逆反应速率的关系是v正
③实验室用Zn和稀硫酸制取H2,反应时溶液中水的电离平衡
a.NaNO3 b.CuSO4 c.Na2SO4 d.NaHSO3
(2)甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇:CO(g)+2H2(g)
CH3OH(g)分析该反应并回答下列问题:
①下列各项中,不能说明该反应已达到平衡的是
a.恒温、恒容条件下,容器内的压强不发生变化
b.一定条件下,CH3OH分解的速率和CH3OH生成的速率相等
c.一定条件下,CO、H2和CH3OH的浓度保持不变
d.一定条件下,单位时间内消耗1mol CO,同时生成l mol CH3OH
②如图甲是该反应在不同温度下CO的转化率随时间变化的曲线.T1和T2温度下的平衡常数大小关系是K1
③已知甲醇燃料电池的工作原理如图乙所示.
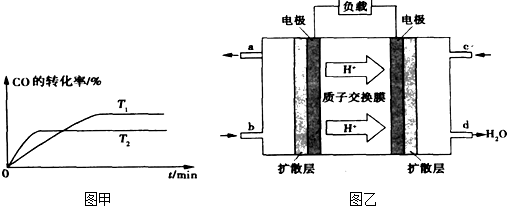
①该电池工作时,b口通入的物质为
查看习题详情和答案>>
(1)氢能在二十一世纪有可能在世界能源舞台上成为一种举足轻重的二次能源.
①硫-碘循环分解水制氢主要涉及下列反应:
I.SO2+2H2O+I2=H2SO4+2HIⅡ.2HI
| 通电 |
分析上述反应,下列判断正确的是
c
c
(填序号,下同).a.反应Ⅲ易在常温下进行 b.反应I中SO2氧化性比HI强
c.循环过程中需补充H2O d.循环过程中产生l mol O2的同时产生1mol H2
②利用甲烷与水反应制备氢气,因原料价廉产氢率高,具有实用推广价值,已知该反应为:CH4(g)+H2O(g)=CO(g)+3H2(g)△H=+206.1kJ?mol-1若800℃时,反应的平衡常数K1=1.0,某时刻测得该温度下,密闭容器中各物质的物质的量浓度分别为:c(CH4)=3.0mol?L-1;c(H2O)=8.5mol?L-1;c(CO)=2.0mol?L-1;c(H2)=2.0mol?L-1,则此时正逆反应速率的关系是v正
>
>
v逆.(填“>”、“<”或“=”)③实验室用Zn和稀硫酸制取H2,反应时溶液中水的电离平衡
向右
向右
移动(填“向左”、“向右”或“不”);若加入少量下列固体试剂中的b
b
,产生H2的速率将增大.a.NaNO3 b.CuSO4 c.Na2SO4 d.NaHSO3
(2)甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇:CO(g)+2H2(g)
| 加热 |
①下列各项中,不能说明该反应已达到平衡的是
d
d
.a.恒温、恒容条件下,容器内的压强不发生变化
b.一定条件下,CH3OH分解的速率和CH3OH生成的速率相等
c.一定条件下,CO、H2和CH3OH的浓度保持不变
d.一定条件下,单位时间内消耗1mol CO,同时生成l mol CH3OH
②如图甲是该反应在不同温度下CO的转化率随时间变化的曲线.T1和T2温度下的平衡常数大小关系是K1
>
>
K2.(填“>”、“<”或“=”)③已知甲醇燃料电池的工作原理如图乙所示.

①该电池工作时,b口通入的物质为
CH3OH
CH3OH
,该电池正极的电极反应式为:O2+4e-+4H+=2H2O
O2+4e-+4H+=2H2O
,工作一段时间后,当6.4g甲醇(CH3OH)完全反应生成CO2时,有1.2
1.2
mol电子发生转移.随着环保意识的增强,清洁能源越来越受人们关注。
(1)氢能在二十一世纪有可能在世界能源舞台上成为一种举足轻重的二次能源。
①硫-碘循环分解水制氢主要涉及下列反应:
I.SO2+2H2O+ I2=H2SO4+2HI
Ⅱ.2HI H2+I2
H2+I2
Ⅲ.2H2SO4=2SO2+O2+2H2O
分析上述反应,下列判断正确的是_________(填序号,下同)。
a.反应Ⅲ易在常温下进行
b.反应I中SO2氧化性比HI强
c.循环过程中需补充H2O
d.循环过程中产生1 mol O2的同时产生1 mol H2
②利用甲烷与水反应制备氢气,因原料价廉产氢率高,具有实用推广价值,已知该反应为:
CH4(g)+H2O(g)=CO(g)+3H2(g) ΔH =+206.1 kJ·mol-1
若800℃时,反应的平衡常数K1=1.0,某时刻测得该温度下,密闭容器中各物质的物质的量浓度分别为:c(CH4)=3.0 mol·L-1;c(H2O)=8.5 mol·L-1;c(CO)=2.0 mol·L-1;c(H2)=2.0 mol·L-1,则此时正逆反应速率的关系是v正___________(填“>”、“<”或“=”) v逆。
③实验室用Zn和稀硫酸制取H2,反应时溶液中水的电离平衡____________移动(填“向左”、“向右”或“不”);若加入少量下列试剂中的_____________,产生H2的速率将增大。
a.NaNO3 b.CuSO4 c.Na2SO4 d.NaHSO3
(2)甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇: CO(g)+2H2(g) CH3OH(g) 分析该反应并回答下列问题:
CH3OH(g) 分析该反应并回答下列问题:
①下列各项中,不能说明该反应已达到平衡的是______________。
a.恒温、恒容条件下,容器内的压强不发生变化
b.一定条件下,CH3OH分解的速率和CH3OH生成的速率相等
c.一定条件下,CO、H2和CH3OH的浓度保持不变
d.一定条件下,单位时间内消耗1 mol CO,同时生成l mol CH3OH
②如图是该反应在不同温度下CO的转化率随时间变化的曲线。
(1)氢能在二十一世纪有可能在世界能源舞台上成为一种举足轻重的二次能源。
①硫-碘循环分解水制氢主要涉及下列反应:
I.SO2+2H2O+ I2=H2SO4+2HI
Ⅱ.2HI
 H2+I2
H2+I2 Ⅲ.2H2SO4=2SO2+O2+2H2O
分析上述反应,下列判断正确的是_________(填序号,下同)。
a.反应Ⅲ易在常温下进行
b.反应I中SO2氧化性比HI强
c.循环过程中需补充H2O
d.循环过程中产生1 mol O2的同时产生1 mol H2
②利用甲烷与水反应制备氢气,因原料价廉产氢率高,具有实用推广价值,已知该反应为:
CH4(g)+H2O(g)=CO(g)+3H2(g) ΔH =+206.1 kJ·mol-1
若800℃时,反应的平衡常数K1=1.0,某时刻测得该温度下,密闭容器中各物质的物质的量浓度分别为:c(CH4)=3.0 mol·L-1;c(H2O)=8.5 mol·L-1;c(CO)=2.0 mol·L-1;c(H2)=2.0 mol·L-1,则此时正逆反应速率的关系是v正___________(填“>”、“<”或“=”) v逆。
③实验室用Zn和稀硫酸制取H2,反应时溶液中水的电离平衡____________移动(填“向左”、“向右”或“不”);若加入少量下列试剂中的_____________,产生H2的速率将增大。
a.NaNO3 b.CuSO4 c.Na2SO4 d.NaHSO3
(2)甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇: CO(g)+2H2(g)
 CH3OH(g) 分析该反应并回答下列问题:
CH3OH(g) 分析该反应并回答下列问题: ①下列各项中,不能说明该反应已达到平衡的是______________。
a.恒温、恒容条件下,容器内的压强不发生变化
b.一定条件下,CH3OH分解的速率和CH3OH生成的速率相等
c.一定条件下,CO、H2和CH3OH的浓度保持不变
d.一定条件下,单位时间内消耗1 mol CO,同时生成l mol CH3OH
②如图是该反应在不同温度下CO的转化率随时间变化的曲线。
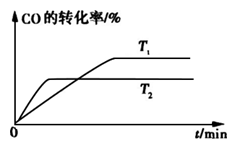
T1和T2温度下的平衡常数大小关系是K1____________(填“>”、“<”或“=”) K2。
③已知甲醇燃料电池的工作原理如图所示。
③已知甲醇燃料电池的工作原理如图所示。

该电池工作时, b口通入的物质为____________,该电池正极的电极反应式为:______________,工作一段时间后,当6.4 g甲醇(CH3OH)完全反应生成CO2时,有___________mol电子发生转移。
查看习题详情和答案>>
与甲醇燃料电池相比,乙醇燃料电池具有毒性低、理论能量密度高等优点,因此被广泛认为是更有前途的燃料电池.图是一个乙醇燃料电池工作时的示意图.乙池中的两个电极均为石墨电极,乙池中盛有100mL 3.00mol/L的CuSO4溶液.请回答下列问题:
(1)N的电极反应式为
(2)在此过程中,乙池中某一电极析出金属铜6.4g时,甲池中理论上消耗氧气
(3)在此过程中,若乙池中两电极产生的气体体积恰好相等时(标准状况下),理论上需通入乙醇
(4)工业上可以利用下列反应制取乙醇:
反应I:2CO2(g)+6H2(g)
CH3CH2OH(g)+3H2O(g) 25℃时.K=2.95×1011
反应II:2CO2(g)+4H2(g)
CH3CH2OH(g)+H2O(g)25℃时,K=1.7l×1022
①写出反应I的平衡常数表达式K=
 ,
,
②条件相同时,反应I与反应II相比,转化程度更大的是
③在一定压强下,测得反应I的实验数据如下表:
根据表中数据分析:温度升高,K值
查看习题详情和答案>>

(1)N的电极反应式为
4OH--4e-=O2↑+2H2O
4OH--4e-=O2↑+2H2O
.(2)在此过程中,乙池中某一电极析出金属铜6.4g时,甲池中理论上消耗氧气
1.12
1.12
L(标准状况下).(3)在此过程中,若乙池中两电极产生的气体体积恰好相等时(标准状况下),理论上需通入乙醇
4.6
4.6
g.(4)工业上可以利用下列反应制取乙醇:
反应I:2CO2(g)+6H2(g)
| ||
反应II:2CO2(g)+4H2(g)
| ||
①写出反应I的平衡常数表达式K=


②条件相同时,反应I与反应II相比,转化程度更大的是
反应II
反应II
.③在一定压强下,测得反应I的实验数据如下表:
温度(K) CO2转化率(%) n(H2)/n(CO2) |
500 | 600 | 700 | 800 |
| 1.5 | 45 | 33 | 20 | 12 |
| 2 | 60 | 43 | 28 | 15 |
| 3 | 83 | 62 | 37 | 22 |
减小
减小
(填“增大”、“减小”或“不变”),提高氢碳比.n(H2)/n(CO2),对生成乙醇有利
有利
(填“不利”或“有利”).