摘要:15.如图表示三种海蟹在其它环境条件一定时.实验条件下.不断改变海水盐度.它们血液浓度的变化情况(已知海水的浓度约为0.5mol/L).表达正确的是( ) (1)在较低浓度的海水才能维持内环境相对稳定的是甲 (2)无法判断 (3)调节渗透压相对稳定能力最弱的是乙 (4)维持内环境相对稳定能力最强的是丙 A. C.
网址:http://m.1010jiajiao.com/timu3_id_279582[举报]
近来,制备和利用氢气这一清洁能源已有多项成果.
(1)德国克莱斯公司成功研制了利用甲醇(CH3OH)车载制氢燃料电池工艺,其原理如图所示,请观察此图回答:
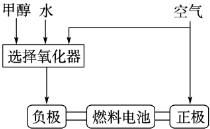
①燃料电池的正极反应式为 ;
②甲醇与流程图中任一反应物反应制取氢气的化学方程式 .
(2)美国Bay等工厂使用石油热裂解的副产物甲烷来制取氢气,其生产流程如图:
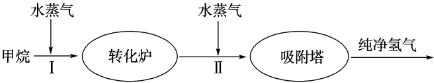
①此流程的第Ⅱ步反应为:CO(g)+H2O(g)?H2(g)+CO2(g),该反应的化学平衡常数表达式为K= ;
②此流程的第Ⅱ步反应的平衡常数随温度的变化如表1,在830℃,以表2的物质的量(单位为mol)投入恒容反应器发生上述反应,其中反应开始时,向正反应方向进行的有 (填实验编号);
表1
表2
③若400℃时,第Ⅱ步反应生成1 mol氢气的热效应值为33.2(单位为kJ),第1步反应的热化学方程式为:
CH4(g)+H2O(g)═3H2(g)+CO(g)△H=-103.3kJ?mol-1
则400℃时,甲烷和水蒸气反应生成二氧化碳和氢气的热化学方程式为 .
(3)我国科学家研究了常温下利用Pt等催化剂在可见光作用下使水分解制氢气的方法,如图是三种催化剂在光照分解水实验中的效果比较图.能得出如图结果的实验方案是 .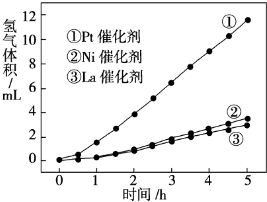
查看习题详情和答案>>
(1)德国克莱斯公司成功研制了利用甲醇(CH3OH)车载制氢燃料电池工艺,其原理如图所示,请观察此图回答:

①燃料电池的正极反应式为
②甲醇与流程图中任一反应物反应制取氢气的化学方程式
(2)美国Bay等工厂使用石油热裂解的副产物甲烷来制取氢气,其生产流程如图:

①此流程的第Ⅱ步反应为:CO(g)+H2O(g)?H2(g)+CO2(g),该反应的化学平衡常数表达式为K=
②此流程的第Ⅱ步反应的平衡常数随温度的变化如表1,在830℃,以表2的物质的量(单位为mol)投入恒容反应器发生上述反应,其中反应开始时,向正反应方向进行的有
表1
| 温度/℃ | 400 | 500 | 830 | 1000 |
| 平衡常数K | 10 | 9 | 1 | 0.6 |
| 实验编号 | n(CO) | n(H2O) | n(H2) | n(CO2) |
| A | 1 | 5 | 2 | 3 |
| B | 2 | 2 | 1 | 1 |
| C | 3 | 3 | 0 | 0 |
| D | 0.5 | 2 | 1 | 1 |
CH4(g)+H2O(g)═3H2(g)+CO(g)△H=-103.3kJ?mol-1
则400℃时,甲烷和水蒸气反应生成二氧化碳和氢气的热化学方程式为
(3)我国科学家研究了常温下利用Pt等催化剂在可见光作用下使水分解制氢气的方法,如图是三种催化剂在光照分解水实验中的效果比较图.能得出如图结果的实验方案是

 (2010?聊城二模)I.科学家一直致力于“人工固氮”的新方法研究.
(2010?聊城二模)I.科学家一直致力于“人工固氮”的新方法研究.(l)目前合成氨技术原理为:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol
如图表示工业合成氨反应在某一段时间中反应速率与反应过程的关系曲线图:
①氢化物的体积分数最高的一段时间为
t0~t1
t0~t1
;t1时刻改变的反应条件是升温
升温
.②NH3极易溶于水,其水溶液俗称氨水.用水稀释0.1mol/L的氨水,溶液中随着水量的增加而减小的是
bd
bd
(填序号).a.
| c(NH4+)?c(OH-) |
| c(NH3?H2O) |
| c(NH3?H2O) |
| c(OH-) |
| c(OH-) |
| c(H+) |
(2)1998年希腊亚里士多德大学的两位科学家采用高质子导电性的SCY冉瓷(能传递H+),实现了高温常压下利用
N2和H2电解合成氨.其阴极的电极反应式
N2+6H++6e-=2NH3
N2+6H++6e-=2NH3
.(3)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生下列反应:2N2(g)+6H2O(1)?4NH3(g)+3O2(g)△H=akJ/mol 进一步研究NH3生成量与温度的关系,常压下达到平衡时测得部分实验数据如下表
| T/K | 303 | 313 | 323 |
| NH3生成量/(10-6mol) | 4.8 | 5.9 | 6.0 |
>
>
0,△S>
>
0,(填“>”“<”或“=”).②已知:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol;2H2(g)+O2(g)=2H2O(g)△H=-571.6kJ/mol 则2N2(g)+6H2O(g)=4NH3(g)+3O2(g)△H=
+l530kJ/mol
+l530kJ/mol
.有机物A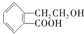 ,它可通过不同的化学反应分别制得B、C和D (如图)三种物质.
,它可通过不同的化学反应分别制得B、C和D (如图)三种物质.
B、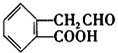 C、
C、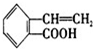 D、
D、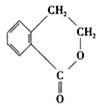
(1)A~D中互为同分异构体的是
(2)由A→B的化学方程式是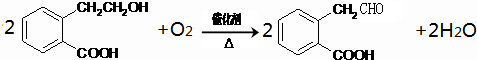

(3)C在一定条件下发生加聚反应的化学方程式是:
 .
.
查看习题详情和答案>>
 ,它可通过不同的化学反应分别制得B、C和D (如图)三种物质.
,它可通过不同的化学反应分别制得B、C和D (如图)三种物质.B、
 C、
C、 D、
D、
(1)A~D中互为同分异构体的是
C和D
C和D
.(2)由A→B的化学方程式是


(3)C在一定条件下发生加聚反应的化学方程式是:


如图表示几种无机物之间的转化关系.其中A、B 均为黑色粉末,B为非金属单质,C 为无色无毒气体,D为金属单质,E 是红棕色气体,G 是具有漂白性的气体,H 的水溶液呈蓝色.
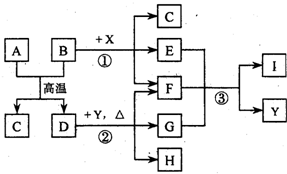
请回答下列问题:
(l) A 的化学式是 ,C 的电子式是 ,Y 的名称是 .
(2)反应①的化学方程式为 .
(3)实验室测定气体E 的相对分子质量时,得到的实验值总是比理论值偏大,其原因是(用化学方程式表示) .
(4)用石墨作电极电解H 的水溶液,电解总反应的离子方程式是 .
(5)推测反应③的还原产物可能是 .
(6)19.2g的D与足量的一定浓度X的溶液反应,将所得的气体与 LO2(标准状况下)混合,恰好能被水完全吸收.
查看习题详情和答案>>

请回答下列问题:
(l) A 的化学式是
(2)反应①的化学方程式为
(3)实验室测定气体E 的相对分子质量时,得到的实验值总是比理论值偏大,其原因是(用化学方程式表示)
(4)用石墨作电极电解H 的水溶液,电解总反应的离子方程式是
(5)推测反应③的还原产物可能是
(6)19.2g的D与足量的一定浓度X的溶液反应,将所得的气体与
I.科学家一直致力于“人工固氮”的新方法研究.
(l)目前合成氨技术原理为:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol
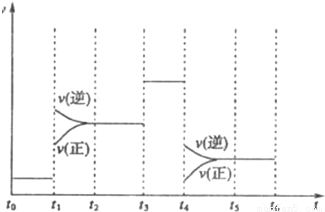
如图表示工业合成氨反应在某一段时间中反应速率与反应过程的关系曲线图:
①氢化物的体积分数最高的一段时间为 ;t1时刻改变的反应条件是 .
②NH3极易溶于水,其水溶液俗称氨水.用水稀释0.1mol/L的氨水,溶液中随着水量的增加而减小的是 (填序号).
a.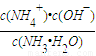 b.
b. c.c(H+).c(OH-)d.
c.c(H+).c(OH-)d.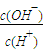
(2)1998年希腊亚里士多德大学的两位科学家采用高质子导电性的SCY冉瓷(能传递H+),实现了高温常压下利用
N2和H2电解合成氨.其阴极的电极反应式 .
(3)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生下列反应:2N2(g)+6H2O(1)?4NH3(g)+3O2(g)△H=akJ/mol 进一步研究NH3生成量与温度的关系,常压下达到平衡时测得部分实验数据如下表
①此合成反应的a 0,△S 0,(填“>”“<”或“=”).
②已知:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol;2H2(g)+O2(g)=2H2O(g)△H=-571.6kJ/mol 则2N2(g)+6H2O(g)=4NH3(g)+3O2(g)△H= .
 查看习题详情和答案>>
查看习题详情和答案>>
(l)目前合成氨技术原理为:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol
如图表示工业合成氨反应在某一段时间中反应速率与反应过程的关系曲线图:
①氢化物的体积分数最高的一段时间为 ;t1时刻改变的反应条件是 .
②NH3极易溶于水,其水溶液俗称氨水.用水稀释0.1mol/L的氨水,溶液中随着水量的增加而减小的是 (填序号).
a.
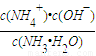 b.
b. c.c(H+).c(OH-)d.
c.c(H+).c(OH-)d.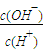
(2)1998年希腊亚里士多德大学的两位科学家采用高质子导电性的SCY冉瓷(能传递H+),实现了高温常压下利用
N2和H2电解合成氨.其阴极的电极反应式 .
(3)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生下列反应:2N2(g)+6H2O(1)?4NH3(g)+3O2(g)△H=akJ/mol 进一步研究NH3生成量与温度的关系,常压下达到平衡时测得部分实验数据如下表
| T/K | 303 | 313 | 323 |
| NH3生成量/(10-6mol) | 4.8 | 5.9 | 6.0 |
②已知:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol;2H2(g)+O2(g)=2H2O(g)△H=-571.6kJ/mol 则2N2(g)+6H2O(g)=4NH3(g)+3O2(g)△H= .
 查看习题详情和答案>>
查看习题详情和答案>>