摘要:已知正四体形分子和直线形分子在光照条件下反应.生成一种直线形分子和变形的四面体(组成分子的元素原子序数均小于18).且分子中的原子处于分子最大原子的下一周期.反应过程图示如下: (1)根据上面的信息可以推测以上物质的分子式:E ,G ,L ,M . (2)在常温下的真空容器中加入1.56g然后通入再通入气体.用电火花引燃直至反应完全.恢复到原来的温度.此时的压强近似为零且生成物中无酸式盐.求:①通入的气体和气体的体积比最小值为 ②通入氧气的量不能超过 克
网址:http://m.1010jiajiao.com/timu3_id_279352[举报]
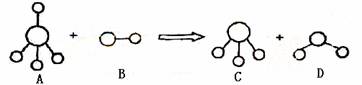
已知结构为正四面体型的离子A和直线型离子B反应,生成三角锥形分子C和V形分子D(A、B、C、D均为10电子微粒,组成它们的元素原子序数均小于10),下列说法正确的是

A.分子C与D不能发生化学反应
B.微粒A的空间结构与CH4相似,它们均为正四面体,所以A是非极性分子
C.固态D的熔沸点明显高于固态H2S的原因在于D分子中的共价键强于S-H键
D.在25℃时,A的盐酸盐溶液的pH小于7
查看习题详情和答案>>
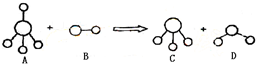
已知结构为正四面体型的离子A和直线型离子B反应,生成三角锥形分子C和V形分子D(A、B、C、D均为10电子微粒,组成它们的元素原子序数均小于10),下列说法正确的是( )
查看习题详情和答案>>

| A.分子C与D不能发生化学反应 |
| B.微粒A的空间结构与CH4相似,它们均为正四面体,所以A是非极性分子 |
| C.固态D的熔沸点明显高于固态H2S的原因在于D分子中的共价键强于S-H键 |
| D.在25℃时,A的盐酸盐溶液的pH小于7 |
已知结构为正四面体型的离子A和直线型离子B反应,生成三角锥形分子C和V形分子D(A、B、C、D均为10电子微粒,组成它们的元素原子序数均小于10),下列说法正确的是( )

A.分子C与D不能发生化学反应
B.微粒A的空间结构与CH4相似,它们均为正四面体,所以A是非极性分子
C.固态D的熔沸点明显高于固态H2S的原因在于D分子中的共价键强于S-H键
D.在25℃时,A的盐酸盐溶液的pH小于7
查看习题详情和答案>>

A.分子C与D不能发生化学反应
B.微粒A的空间结构与CH4相似,它们均为正四面体,所以A是非极性分子
C.固态D的熔沸点明显高于固态H2S的原因在于D分子中的共价键强于S-H键
D.在25℃时,A的盐酸盐溶液的pH小于7
查看习题详情和答案>>