摘要:15.将铁的粉末投入到稀硝酸中.待反应停止后铁有剩余.则溶液中有 A.Fe3 B.Fe(NO3)2 C.Fe(NO3)3 D.HNO3
网址:http://m.1010jiajiao.com/timu3_id_277594[举报]
将铜粉与铁粉组成的混合物投入到稀硝酸中充分反应后,滤出不溶物,将此不溶物又投入到盐酸中,未见H2逸出,下列说法正确的是( )
A.滤液中一定有Fe2+ B.滤液中一定有Fe3+
C.滤液中一定有Fe2+、Cu2+ D.滤液中一定有Fe2+、Fe3+、Cu2+
查看习题详情和答案>>
将铜粉与铁粉组成的混合物投入到稀硝酸中,充分反应后,滤出不溶物,将此不溶物再投入到盐酸中,未见有H2逸出。下列说法正确的是 ()。
A.滤液中一定有Fe2+
B.滤液中一定有Fe3+
C.滤液中一定有Fe2+、Cu2+
D.滤液中一定有Fe2+、Fe3+、Cu2+ 查看习题详情和答案>>
A.滤液中一定有Fe2+
B.滤液中一定有Fe3+
C.滤液中一定有Fe2+、Cu2+
D.滤液中一定有Fe2+、Fe3+、Cu2+ 查看习题详情和答案>>
将9g铜和铁的混合物投入100mL稀硝酸中,充分反应后得到标准状况下1.12L NO,剩余4.8g金属;继续加入100mL等浓度的稀硝酸,金属完全溶解,又得到标准状况下1.12L NO.若向反应后的溶液中加入KSCN溶液,溶液不变红,则下列说法正确的是( )
| A、原混合物中铜和铁各0.075mol | B、稀硝酸的物质的量浓度为0.5mol?L-1 | C、第一次剩余4.8g金属为铜和铁 | D、再加入上述100mL稀硝酸,又得到标准状况下1.12L NO |
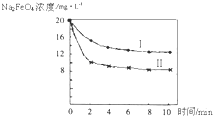 (2012?朝阳区一模)高铁酸钠(Na2FeO4)具有很强的氧化性,是一种新型的绿色净水消毒剂.工业上可以通过次氯酸钠氧化法制备高铁酸钠,生产过程如下:
(2012?朝阳区一模)高铁酸钠(Na2FeO4)具有很强的氧化性,是一种新型的绿色净水消毒剂.工业上可以通过次氯酸钠氧化法制备高铁酸钠,生产过程如下: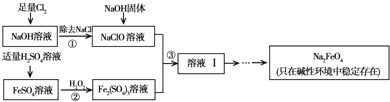
回答下列问题:
(1)氢氧化钠的电子式是


(2)经过步骤①后,加入NaOH固体的原因是
Na2FeO4只在碱性环境中稳定存在,所以加入氢氧化钠可以调节溶液显碱性
Na2FeO4只在碱性环境中稳定存在,所以加入氢氧化钠可以调节溶液显碱性
.(3)步骤②反应的离子方程式是
2Fe2++H2O2+2H+=2Fe3++2H2O
2Fe2++H2O2+2H+=2Fe3++2H2O
.(4)从溶液Ⅰ中分离出Na2FeO4后,还有副产品Na2SO4、NaCl,则步骤③中反应的离子方程式为
2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O
2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O
.(5)将一定量的Na2FeO4投入到pH不同的污水中(污水中其余成分均相同),溶液中Na2FeO4浓度变化如图曲线Ⅰ、Ⅱ所示,试推测曲线I比曲线II对应的污水pH
高
高
(填“高”或“低”).(6)通过计算得知Na2FeO4的消毒效率(以单位质量得到的电子数表示)比氯气的
低
低
(填“高”或“低”),用高铁酸钠代替氯气作净水消毒剂的优点是既能消毒杀菌又能净水
既能消毒杀菌又能净水
(答出两点即可).