摘要:12. 在0.1 mol·L-1 NH3·H2O溶液中存在如下电离平衡:NH3·H2O NH4+ + OH- .对于该平衡.下列叙述中正确的是 A.降低温度.溶液中c(NH4+)增大 B.加入少量NaOH固体.平衡向逆反应方向移动.电离平衡常数减小 C.加入少量0.1 mol·L-1 HCl溶液.溶液中c(OH-)增大 D.加入水时.溶液中c(OH-) / c(NH3·H2O) 增大
网址:http://m.1010jiajiao.com/timu3_id_277544[举报]
在0.1 mol?L-1的CH3COOH溶液中存在如下电离平衡:CH3COOH?CH3COO-+H+,
(1)请根据该平衡完成下列表格(电离平衡移动方向填“正方向”或“逆方向”,离子浓度、电离度的变化请用“增大”、“减小”或“不变”表示).
(2)在25℃下,将a mol/L的氨水与上述0.1 mol?L-1的CH3COOH溶液等体积混合,所得溶液中c(NH4+)=c(CH3COO-),则溶液显
.
查看习题详情和答案>>
(1)请根据该平衡完成下列表格(电离平衡移动方向填“正方向”或“逆方向”,离子浓度、电离度的变化请用“增大”、“减小”或“不变”表示).
| 改变条件 | 电离平衡移动 方向 |
电离度 | c(H+) | c(CH3COO-) |
| 加水稀释 | ||||
| 加少量HCl溶液 | ||||
| 加入少量CH3COONa固体 |
中
中
性(填“酸”、“碱”或“中”);请写出NH3?H2O的电离常数Kb=| c(NH4+).c(OH-) |
| c(NH3.H2O) |
| c(NH4+).c(OH-) |
| c(NH3.H2O) |
在0.1 mol·L-1NH3·H2O溶液中存在如下电离平衡:NH3·H2O NH4+ + OH-。对于该平衡,下列叙述中正确的是
NH4+ + OH-。对于该平衡,下列叙述中正确的是
 NH4+ + OH-。对于该平衡,下列叙述中正确的是
NH4+ + OH-。对于该平衡,下列叙述中正确的是 [ ]
A.降低温度,溶液中c(NH4+)增大
B.加入少量NaOH固体,平衡向逆反应方向移动,电离平衡常数减小
C.加入少量0.1 mol·L-1HCl溶液,溶液中c(OH-)增大
D.加入水时,溶液中c(OH-)/c(NH3·H2O) 增大
查看习题详情和答案>>
B.加入少量NaOH固体,平衡向逆反应方向移动,电离平衡常数减小
C.加入少量0.1 mol·L-1HCl溶液,溶液中c(OH-)增大
D.加入水时,溶液中c(OH-)/c(NH3·H2O) 增大
在一定条件下,存在如下反应:2SO2(g)+O2(g)![]() 2SO3(g);ΔH<0
2SO3(g);ΔH<0
(1)写出该反应的化学平衡常数表达式K=________
(2)升高温度,该反应K值________,SO2转化率________,正反应速率________(填增大、减小或不变)
(3)600℃时,在一密闭容器中,将二氧化硫和氧气混合,反应过程中SO2、O2、SO3物质的量变化如图,反应处于平衡状态的时间是________
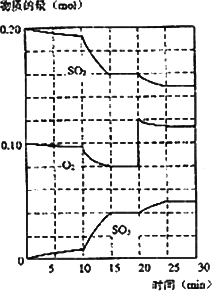
(4)据图判断,反应进行至20 min时,曲线发生变化的原因是________(用文字表达),10 min到15 min的曲线变化的原因可能是________(填编号).
A.加了催化剂
B.缩小容器体积
C.降低温度
D.增加SO3物质的量
(5)在25℃下,将amol/L的氨水与0.01 mol/L的盐酸等体积混合,反应平衡时溶液中c(NH![]() )=c(Cl-),则溶液显________性(填“酸”“碱”或“中”);用含a的代数式表示NH3·H2O的电离常数Kb=________.
)=c(Cl-),则溶液显________性(填“酸”“碱”或“中”);用含a的代数式表示NH3·H2O的电离常数Kb=________.
中学化学中的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡4种,且均符合平衡移动原理.请回答下列问题:
Ⅰ.常温下有浓度均为0.1mol?L-1的四种溶液:①NaHCO3、②Na2CO3、③HCl、④NH3?H2O.
(1)溶液①、②、③pH值由小到大的顺序为
(2)向④中加入少量氯化铵固体,此时c(NH4+)/c(OH-)的值
(3)取10mL溶液③,加水稀释到100mL,则此时溶液中由水电离出的c(H+)=
(4)上述溶液中,既能与氢氧化钠溶液反应,又能和硫酸反应的溶液中离子浓度由大到小的顺序为
(5)若将③和④的溶液混合后溶液恰好呈中性,则混合前③的体积
Ⅱ.难溶电解质在水溶液中存在溶解平衡.在常温下,溶液中各离子浓度以它们化学计量数为指数的乘积是一个常数,叫溶度积常数(Ksp).当溶液中各离子浓度指数的乘积大于溶度积时,则产生沉淀,反之固体溶解.若某CuSO4溶液中c(Cu2+)=0.02mol?L-1,如果生成Cu(OH)2沉淀,应调整溶液pH,使之大于
查看习题详情和答案>>
Ⅰ.常温下有浓度均为0.1mol?L-1的四种溶液:①NaHCO3、②Na2CO3、③HCl、④NH3?H2O.
(1)溶液①、②、③pH值由小到大的顺序为
③<①<②
③<①<②
.(填序号)(2)向④中加入少量氯化铵固体,此时c(NH4+)/c(OH-)的值
增大
增大
(填“增大”、“减小”或“不变”).(3)取10mL溶液③,加水稀释到100mL,则此时溶液中由水电离出的c(H+)=
10-12 mol?L-1
10-12 mol?L-1
.(4)上述溶液中,既能与氢氧化钠溶液反应,又能和硫酸反应的溶液中离子浓度由大到小的顺序为
c(Na+)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-)
c(Na+)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-)
.(5)若将③和④的溶液混合后溶液恰好呈中性,则混合前③的体积
小于
小于
④的体积(填“大于”、“小于”或“等于”).Ⅱ.难溶电解质在水溶液中存在溶解平衡.在常温下,溶液中各离子浓度以它们化学计量数为指数的乘积是一个常数,叫溶度积常数(Ksp).当溶液中各离子浓度指数的乘积大于溶度积时,则产生沉淀,反之固体溶解.若某CuSO4溶液中c(Cu2+)=0.02mol?L-1,如果生成Cu(OH)2沉淀,应调整溶液pH,使之大于
5
5
(已知Ksp=2.0×10-20).