摘要:11.气体物质的溶解度与温度压强的关系:气体物质的溶解度随温度的升高而减小.随压强的增大而增大. 例题分析: 例题1 有下列物质:①牛奶 ②无水酒精 ③澄清石灰水 ④波尔多液 ⑤向澄清石灰水中通人少量二氧化碳后的液体 ⑥锌溶解在适量的稀硫酸中形成的液体.其中属于溶液的是 .溶液中的溶质是 . 分析:此题是考查关于溶液.溶质和溶剂的概念.同时要求区分溶液.悬浊液和乳浊液.根据悬浊液.乳浊液.溶液概念和特征可知:牛奶是乳浊液,波尔多液是悬浊液,澄清石灰水是溶液,向澄清石灰水中通人二氧化碳后发生如下反应:CO2+Ca(OH)2=CaCO3↓+H2O由于生成了不溶于水的碳酸钙.故形成的混合物是悬浊液,锌溶解在稀硫酸中存在反应:Zn+H2SO4=ZnSO4+H2↑.生成的硫酸锌溶于水中形成硫酸锌溶液.溶质应为硫酸锌而不是锌,无水酒精属于纯净物.不是溶液.正确答案 ③⑥.Ca(OH)2 .ZnSO4. 例题2 下列说法正确的是( ) A.在氯化钠的饱和溶液中.不能再继续溶解任何物质 B.所有不饱和溶液都可以通过降低温度来达到饱和状态 C.若对将要成为饱和状态的溶液.只要蒸发溶剂一定能成为饱和溶液 D.当某饱和溶液析出晶体后.剩余溶液中溶质质量分数不一定减小 分析:选项A是没有抓住饱和溶液的关键词“一定温度.一定量的溶剂 .若改变温度.就能继续溶解NaCl,另外在同一温度下.饱和NaCl溶液还是可以继续溶解蔗糖等其他溶质的.选项B对大多数溶质而言.不饱和溶液可以通过降低温度来达到饱和状态.但对某些溶解度随温度降低而增大的物质如Ca(OH)2.温度降低.反而由饱和状态变为不饱和状态了.选项C.若200C的KN03溶液.即使是饱和的.但蒸发少量溶剂后保持一定的温度(如800C)时.可能会成为不饱和溶液了.选项D中.不仅注意到了溶质量的减少.同时也意识到了析出晶体的方式是多种多样的.若是通过蒸发溶剂而析出晶体的.剩余溶液的质量分数就与前者相同了.正确答案 D 自我评价:
网址:http://m.1010jiajiao.com/timu3_id_27704[举报]
溶解度:
(1)固体溶解度是在一定温度下,在100g溶剂里,某固态物质达到 时所溶解的 .
①多数固体物质的溶解度随着温度的升高而增大,如 .
②少数固体物质的溶解度受温度的影响很小,如 .
③极少数固体物质的溶解度随着温度的升高而减小,如 .
(2)室温下,固体溶质的溶解度与其溶解性之间的关系,为了方便记忆,可用数轴表示:
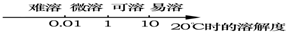
①溶解度小于0.01g则为 ;②溶解度在0.01g~1g则为 ;③溶解度在1g~10g则为 ;④溶解度大于10g则为 .
(3)影响气体溶解度的因素分别有温度和压强.气体溶解度随着温度的升高而 ,随着压强的增大而 .
查看习题详情和答案>>
(1)固体溶解度是在一定温度下,在100g溶剂里,某固态物质达到
①多数固体物质的溶解度随着温度的升高而增大,如
②少数固体物质的溶解度受温度的影响很小,如
③极少数固体物质的溶解度随着温度的升高而减小,如
(2)室温下,固体溶质的溶解度与其溶解性之间的关系,为了方便记忆,可用数轴表示:
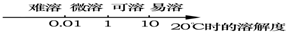
①溶解度小于0.01g则为
(3)影响气体溶解度的因素分别有温度和压强.气体溶解度随着温度的升高而
超临界流体(SCF)是指流体的温度和压力处于它的临界温度(Tc)和临界压力(Pc)以上时的一种特殊状态的流体.它兼具气态和液态的特征,同时又具有许多独特的性质,如无机盐在超临界水(SCW)中的溶解度很低,而有机物和氧气、氮气以及二氧化碳等气体则与超临界水完全互溶等.水的状态与压强、温度关系如图示意:
(1)指出三相点对应的温度和压强______、______.
(2)在200℃、10MPa时,水的状态是______,使之成为超临界水的必要措施为______.
(3)80年代中期美国学者Modell首次提出超临界水氧化技术(SCWO),即以超临界水为介质,用空气、氧气等氧化剂将有机废物氧化成二氧化碳、氮气、水以及盐类(SO42-、PO43-)等无毒小分子,反应过程中放热.该项技术很快在航天领域得到应用,生产火箭燃料的工业废水中含有少量的偏二甲肼[C2H8N2],偏二甲肼[C2H8N2]属于______(填一种物质类别),利用SCWO技术,偏二甲肼能迅速和双氧水反应,该反应的化学方程式为______.该项技术处理废水时,除了反应彻底、迅捷和广泛的适用性外,还具有的优点是______.
(4)根据短文中的意思判断下列说法不正确的是______
A.超临界态水是一种新物质B.超临界态水不会形成二次污染
C.超临界态水是一种新型催化剂D.超临界态水不可用于解决白色污染问题
(5)工业上利用SCWO技术对一些难降解的有机废水进行处理.在处理某些含可溶性无机盐(只含钠盐、钾盐)的有机废水时,常常会出现管道堵塞现象,发生这种现象的原因是______,定期清洗堵塞管道的方法是______.

查看习题详情和答案>>
(1)指出三相点对应的温度和压强______、______.
(2)在200℃、10MPa时,水的状态是______,使之成为超临界水的必要措施为______.
(3)80年代中期美国学者Modell首次提出超临界水氧化技术(SCWO),即以超临界水为介质,用空气、氧气等氧化剂将有机废物氧化成二氧化碳、氮气、水以及盐类(SO42-、PO43-)等无毒小分子,反应过程中放热.该项技术很快在航天领域得到应用,生产火箭燃料的工业废水中含有少量的偏二甲肼[C2H8N2],偏二甲肼[C2H8N2]属于______(填一种物质类别),利用SCWO技术,偏二甲肼能迅速和双氧水反应,该反应的化学方程式为______.该项技术处理废水时,除了反应彻底、迅捷和广泛的适用性外,还具有的优点是______.
(4)根据短文中的意思判断下列说法不正确的是______
A.超临界态水是一种新物质B.超临界态水不会形成二次污染
C.超临界态水是一种新型催化剂D.超临界态水不可用于解决白色污染问题
(5)工业上利用SCWO技术对一些难降解的有机废水进行处理.在处理某些含可溶性无机盐(只含钠盐、钾盐)的有机废水时,常常会出现管道堵塞现象,发生这种现象的原因是______,定期清洗堵塞管道的方法是______.

(1)水是生命之源,也是人类最宝贵的资源.用你学过的化学知识回答下列问题:
①某同学在完成电解水实验时,发现正极产生了20mL气体,则负极产生的气体体积是
②硬水可用
③硬水在加热或久置时,铝壶中会产生水垢[主要成分含有CaCO3],生活中可用适量稀盐酸除去热水瓶壁上的水垢,写出有关反应的化学方程式
④在潮湿时,铁制品易生锈,可用适量稀盐酸除去,写出有关反应的化学方程式
(2)大气是大自然对人类的恩赐,与人类的生存休戚相关.
①将空气中的二氧化碳输送到冰冷的深海中贮藏.二氧化碳在深海中的溶解度比通常情况下在水中的溶解度大,原因是
②“节能减排”是我国的重要国策,过多的CO2排放会造成
③能源问题是当今世界三大问题之一,下列有关能源的叙述中不正确的是
A.乙醇汽油中添加的乙醇属于可再生能源
B.人类通过化石燃料获得能量的过程是物理变化
C.将煤球制成“蜂窝煤”是为了增大与空气的接触面积,使其燃烧更充分
D.我国南海海底储藏了大量“可燃冰”,它将成为替代化石燃料的新能源
(3)A-F和X都是初中化学中的常见物质,其中A、C是无色气体,B、F是红色固体,它们的转化关系如图所示(部分生成物已省略):
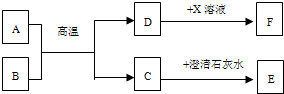
①D的化学式为
②写出A和B反应的化学方程式
③请写出防止含D的生活用品腐蚀的常用方法
查看习题详情和答案>>
①某同学在完成电解水实验时,发现正极产生了20mL气体,则负极产生的气体体积是
40mL
40mL
.该实验能够说明水是由氢元素与氧元素组成的依据是化学反应前后元素种类不变
化学反应前后元素种类不变
②硬水可用
肥皂水
肥皂水
来检验,生活中可用煮沸
煮沸
来降低水的硬度.③硬水在加热或久置时,铝壶中会产生水垢[主要成分含有CaCO3],生活中可用适量稀盐酸除去热水瓶壁上的水垢,写出有关反应的化学方程式
CaCO3+2HCl═CaCl2+2H2O+CO2↑
CaCO3+2HCl═CaCl2+2H2O+CO2↑
.④在潮湿时,铁制品易生锈,可用适量稀盐酸除去,写出有关反应的化学方程式
Fe2O3+6HCl═2FeCl3+3H2O
Fe2O3+6HCl═2FeCl3+3H2O
.(2)大气是大自然对人类的恩赐,与人类的生存休戚相关.
①将空气中的二氧化碳输送到冰冷的深海中贮藏.二氧化碳在深海中的溶解度比通常情况下在水中的溶解度大,原因是
CO2的溶解度随温度降低而增大和压强增大而增大
CO2的溶解度随温度降低而增大和压强增大而增大
.②“节能减排”是我国的重要国策,过多的CO2排放会造成
温室
温室
效应.③能源问题是当今世界三大问题之一,下列有关能源的叙述中不正确的是
B
B
.A.乙醇汽油中添加的乙醇属于可再生能源
B.人类通过化石燃料获得能量的过程是物理变化
C.将煤球制成“蜂窝煤”是为了增大与空气的接触面积,使其燃烧更充分
D.我国南海海底储藏了大量“可燃冰”,它将成为替代化石燃料的新能源
(3)A-F和X都是初中化学中的常见物质,其中A、C是无色气体,B、F是红色固体,它们的转化关系如图所示(部分生成物已省略):

①D的化学式为
Fe
Fe
.②写出A和B反应的化学方程式
Fe2O3+3CO
2Fe+3CO2
| ||
Fe2O3+3CO
2Fe+3CO2
.
| ||
③请写出防止含D的生活用品腐蚀的常用方法
刷漆、涂油、电镀
刷漆、涂油、电镀
.(写一种)(2006?绵阳)(1)某元素的原子结构示意图为 ,它的原子核内有
,它的原子核内有
(2)夏天,打开汽水瓶盖时,汽水会自动喷出来,如果打开冰冻汽水的瓶盖,则只有少许气泡冒出.上述事实表明,气体的溶解度随外界条件的变化关系是
(3)孔雀石能发生如下图所示变化:
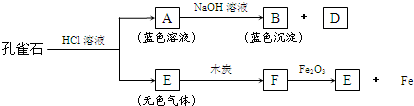
①推断A、B、D、E是何种物质,写出它们的化学式:
A
②从图中转化关系可以初步判断,孔雀石中含有的元素是
③F跟Fe2O3反应的化学方程式是
(4)人体内的钙99% 存在于骨骼和牙齿中,主要以羟基磷酸钙晶体的形式存在.羟基磷酸钙的化学式为Ca10(PO4)6(OH)x,其中x=
查看习题详情和答案>>
 ,它的原子核内有
,它的原子核内有16
16
个质子,它与核电荷数为11的元素形成的化合物化学式为Na2S
Na2S
,它与地壳中含量最多的元素形成的一种大气污染物化学式为SO2
SO2
.(2)夏天,打开汽水瓶盖时,汽水会自动喷出来,如果打开冰冻汽水的瓶盖,则只有少许气泡冒出.上述事实表明,气体的溶解度随外界条件的变化关系是
气体溶解度随压强减小而减小
气体溶解度随压强减小而减小
,随温度降低而增大
随温度降低而增大
.(3)孔雀石能发生如下图所示变化:

①推断A、B、D、E是何种物质,写出它们的化学式:
A
CuCl2
CuCl2
,BCu(OH)2
Cu(OH)2
,DNaCl
NaCl
,ECO2
CO2
.②从图中转化关系可以初步判断,孔雀石中含有的元素是
Cu和C
Cu和C
.③F跟Fe2O3反应的化学方程式是
3CO+Fe2O3
2Fe+3CO2
| ||
3CO+Fe2O3
2Fe+3CO2
,该反应中具有还原性的物质是
| ||
CO
CO
.(4)人体内的钙99% 存在于骨骼和牙齿中,主要以羟基磷酸钙晶体的形式存在.羟基磷酸钙的化学式为Ca10(PO4)6(OH)x,其中x=
2
2
.乳酸钙是一种常用的人体补钙剂,它的化学式为 (C3H5O3)2Ca,则乳酸钙中C、H、O三种元素的质量比为36:5:48
36:5:48
.钙元素的质量分数为18.3%
18.3%
.(2013?焦作模拟)硝酸钾是农业上常用的一种化肥,能够使农作物枝叶繁茂、增强抗倒伏、抗病虫害的能力,硝酸钾属于化肥中的
(1)为了探究硝酸钾固体在水中溶解质量多少的影响因素,某研究小组开展了以下的探究活动,请你根据实验数据归纳出结论.
实验一:KNO3在20℃水中达到饱和时溶解的质量
结论:当
实验二:KNO3在20g水中达到饱和时溶解的质量
结论:当水的质量相同时,
讨论:如果是气体物质,除上述因素外,影响其在水中溶解质量多少的因素还有
(2)如图所示,小烧杯中盛放的是硝酸钾饱和溶液.若将少量的下列物质分别小心地加入到大烧杯的水中,不断搅拌,一定能够使小烧杯中有固体析出的是
A.冰块 B.浓硫酸 C.硝酸铵 D.氢氧化钠 E.氧化钙
(3)请填充表中空白并根据下列实验和上述有关信息回答问题:(已知水的密度约为1g/cm3)
一定属于不饱和溶液的是
(4)将10mL98%浓硫酸(密度为1.82g/mL)中加水稀释至100mL,取10mL该稀硫酸与足量锌反应制取氢气,请按要求完成系列问题的解答(计算结果保留一位小数):
①10mL98%的浓硫酸中含
②列式计算消耗金属锌的质量.
查看习题详情和答案>>
复合肥
复合肥
.硝酸钾与任何酸、碱、盐都不会发生复分解反应,其原因是钾盐、硝酸盐都易溶于水或不可能生成沉淀、气体或水
钾盐、硝酸盐都易溶于水或不可能生成沉淀、气体或水
.(1)为了探究硝酸钾固体在水中溶解质量多少的影响因素,某研究小组开展了以下的探究活动,请你根据实验数据归纳出结论.
实验一:KNO3在20℃水中达到饱和时溶解的质量
| 水的质量(g) | 10 | 50 | 100 |
| KNO3的质量(g) | 3.2 | 15.8 | 31.6 |
温度
温度
相同时,水的质量越多,溶解KNO3的质量越多.实验二:KNO3在20g水中达到饱和时溶解的质量
| 温度(℃) | 20 | 40 | 60 |
| KNO3的质量(g) | 6.3 | 12.8 | 22.0 |
温度越高,溶解KNO3的质量越多
温度越高,溶解KNO3的质量越多
.讨论:如果是气体物质,除上述因素外,影响其在水中溶解质量多少的因素还有
气体的压强(或气体的性质)
气体的压强(或气体的性质)
(写一种).(2)如图所示,小烧杯中盛放的是硝酸钾饱和溶液.若将少量的下列物质分别小心地加入到大烧杯的水中,不断搅拌,一定能够使小烧杯中有固体析出的是
AC
AC
(填字母).A.冰块 B.浓硫酸 C.硝酸铵 D.氢氧化钠 E.氧化钙
(3)请填充表中空白并根据下列实验和上述有关信息回答问题:(已知水的密度约为1g/cm3)
| 实验操作 | 实验现象和溶解程度 | 实验结果 |
| 取100mL水,加入25g硝酸钾,搅拌,恢复至20℃ | 全部溶解 | 得溶液① |
| 再加w g硝酸钾,搅拌,恢复至20℃ | 恰好饱和 | 得溶液② |
| 再加25g硝酸钾,搅拌,恢复至20℃ | 不溶解 | 得溶液③ |
| 加热 | 全部溶解 | 得溶液④ |
| 冷却至20℃ | 析出晶体a | 得溶液⑤ |
| 蒸发掉10g水,恢复至20℃ | 析出晶体b | 得溶液⑥ |
①
①
(填序号,下同);溶质的质量分数一定相等的是②③⑤⑥
②③⑤⑥
;上述操作中w、晶体a、晶体b的质量都可以推理出来,其中析出晶体b的质量为3.16g
3.16g
.(4)将10mL98%浓硫酸(密度为1.82g/mL)中加水稀释至100mL,取10mL该稀硫酸与足量锌反应制取氢气,请按要求完成系列问题的解答(计算结果保留一位小数):
①10mL98%的浓硫酸中含
17.8
17.8
g H2SO4.(不需要写出计算过程)②列式计算消耗金属锌的质量.