题目内容
(2013?焦作模拟)硝酸钾是农业上常用的一种化肥,能够使农作物枝叶繁茂、增强抗倒伏、抗病虫害的能力,硝酸钾属于化肥中的
(1)为了探究硝酸钾固体在水中溶解质量多少的影响因素,某研究小组开展了以下的探究活动,请你根据实验数据归纳出结论.
实验一:KNO3在20℃水中达到饱和时溶解的质量
结论:当
实验二:KNO3在20g水中达到饱和时溶解的质量
结论:当水的质量相同时,
讨论:如果是气体物质,除上述因素外,影响其在水中溶解质量多少的因素还有
(2)如图所示,小烧杯中盛放的是硝酸钾饱和溶液.若将少量的下列物质分别小心地加入到大烧杯的水中,不断搅拌,一定能够使小烧杯中有固体析出的是
A.冰块 B.浓硫酸 C.硝酸铵 D.氢氧化钠 E.氧化钙
(3)请填充表中空白并根据下列实验和上述有关信息回答问题:(已知水的密度约为1g/cm3)
一定属于不饱和溶液的是
(4)将10mL98%浓硫酸(密度为1.82g/mL)中加水稀释至100mL,取10mL该稀硫酸与足量锌反应制取氢气,请按要求完成系列问题的解答(计算结果保留一位小数):
①10mL98%的浓硫酸中含
②列式计算消耗金属锌的质量.
复合肥
复合肥
.硝酸钾与任何酸、碱、盐都不会发生复分解反应,其原因是钾盐、硝酸盐都易溶于水或不可能生成沉淀、气体或水
钾盐、硝酸盐都易溶于水或不可能生成沉淀、气体或水
.(1)为了探究硝酸钾固体在水中溶解质量多少的影响因素,某研究小组开展了以下的探究活动,请你根据实验数据归纳出结论.
实验一:KNO3在20℃水中达到饱和时溶解的质量
| 水的质量(g) | 10 | 50 | 100 |
| KNO3的质量(g) | 3.2 | 15.8 | 31.6 |
温度
温度
相同时,水的质量越多,溶解KNO3的质量越多.实验二:KNO3在20g水中达到饱和时溶解的质量
| 温度(℃) | 20 | 40 | 60 |
| KNO3的质量(g) | 6.3 | 12.8 | 22.0 |
温度越高,溶解KNO3的质量越多
温度越高,溶解KNO3的质量越多
.讨论:如果是气体物质,除上述因素外,影响其在水中溶解质量多少的因素还有
气体的压强(或气体的性质)
气体的压强(或气体的性质)
(写一种).(2)如图所示,小烧杯中盛放的是硝酸钾饱和溶液.若将少量的下列物质分别小心地加入到大烧杯的水中,不断搅拌,一定能够使小烧杯中有固体析出的是
AC
AC
(填字母).A.冰块 B.浓硫酸 C.硝酸铵 D.氢氧化钠 E.氧化钙
(3)请填充表中空白并根据下列实验和上述有关信息回答问题:(已知水的密度约为1g/cm3)
| 实验操作 | 实验现象和溶解程度 | 实验结果 |
| 取100mL水,加入25g硝酸钾,搅拌,恢复至20℃ | 全部溶解 | 得溶液① |
| 再加w g硝酸钾,搅拌,恢复至20℃ | 恰好饱和 | 得溶液② |
| 再加25g硝酸钾,搅拌,恢复至20℃ | 不溶解 | 得溶液③ |
| 加热 | 全部溶解 | 得溶液④ |
| 冷却至20℃ | 析出晶体a | 得溶液⑤ |
| 蒸发掉10g水,恢复至20℃ | 析出晶体b | 得溶液⑥ |
①
①
(填序号,下同);溶质的质量分数一定相等的是②③⑤⑥
②③⑤⑥
;上述操作中w、晶体a、晶体b的质量都可以推理出来,其中析出晶体b的质量为3.16g
3.16g
.(4)将10mL98%浓硫酸(密度为1.82g/mL)中加水稀释至100mL,取10mL该稀硫酸与足量锌反应制取氢气,请按要求完成系列问题的解答(计算结果保留一位小数):
①10mL98%的浓硫酸中含
17.8
17.8
g H2SO4.(不需要写出计算过程)②列式计算消耗金属锌的质量.
分析:根据复分解反应的条件和控制实验变量的原理(即“只改变某一个实验变量而控制其它变量不变,从而获得该变量对实验结果的影响”),实验一是温度相同时不同量的溶剂的溶解量,实验二是水量一定温度改变时的溶解量;并根据硫酸的质量结合锌与硫酸反应的方程式进行计算.
解答:解:含氮、磷、钾三种元素中一种的肥料分别是氮肥、磷肥、钾肥,若含氮、磷、钾中的两种或两种以上的肥料则是复合肥,因硝酸钾中含营养元素中的氮和钾两种元素,故为复合肥;
根据复分解反应发生的条件:生成沉淀、气体或水可知,硝酸钾中的离子是钾离子和硝酸根离子,而钾盐、硝酸盐都易溶于水,不可能生成沉淀、气体或水;
故答案为:复合肥;钾盐、硝酸盐都易溶于水或不可能生成沉淀、气体或水;
(1)根据控制实验变量的原理,实验一是控制温度相同,探究改变水的质量对溶解KNO3的质量的影响;实验二是控制水的质量相同,探究改变温度对溶解KNO3的质量的影响.如果是气体物质,除上述因素(温度、水的质量)外,影响其在水中溶解质量多少的因素还有气体的压强(外因)和气体的性质(内因);
故答案为:
实验一:温度;
实验二:温度越高,溶解KNO3的质量越多; 气体的压强(或气体的性质);
(2)通过改变温度使硝酸钾晶体析出,因为硝酸钾的溶解度随温度的升高而增大;故A.冰块溶解吸热会使溶液的温度降低,C.硝酸铵溶于水会吸收热量是溶液的温度降低,二者都可以间接使硝酸钾通过降温而结晶析出;
故选AC;
(3)步骤2恰好饱和,故为饱和溶液;从而也说明溶液①是不饱和溶液;步骤3是在步骤2的基础上继续加溶质,不能继续溶解,故为饱和溶液;步骤4只是加热,看到全部溶解,可能是饱和溶液,也可能是不饱和溶液;步骤5又降温到20℃,故为饱和溶液;步骤6在饱和溶液的基础上蒸发10g水,恢复至20℃,仍为饱和溶液,析出晶体的质量是3.16g;因为②③⑤⑥的溶液都是20℃时的硝酸钾饱和溶液,溶解度相等,故溶质质量分数也相等;
故答案为:
①; ②③⑤⑥; 3.16g;
(4)①10ml98%的浓硫酸中含硫酸的质量是:1.82g/ml×10ml×98%=17.8g;
故答案为:
①17.8;
②参加反应的硫酸的质量是:17.8g×
=1.78g
设 10ml稀硫酸与锌完全反应消耗锌的质量为X
Zn+H2SO4=ZnSO4+H2↑
65 98
X 1.78g
=
解之:X=1.2g
答:消耗金属锌的质量是1.2g.
根据复分解反应发生的条件:生成沉淀、气体或水可知,硝酸钾中的离子是钾离子和硝酸根离子,而钾盐、硝酸盐都易溶于水,不可能生成沉淀、气体或水;
故答案为:复合肥;钾盐、硝酸盐都易溶于水或不可能生成沉淀、气体或水;
(1)根据控制实验变量的原理,实验一是控制温度相同,探究改变水的质量对溶解KNO3的质量的影响;实验二是控制水的质量相同,探究改变温度对溶解KNO3的质量的影响.如果是气体物质,除上述因素(温度、水的质量)外,影响其在水中溶解质量多少的因素还有气体的压强(外因)和气体的性质(内因);
故答案为:
实验一:温度;
实验二:温度越高,溶解KNO3的质量越多; 气体的压强(或气体的性质);
(2)通过改变温度使硝酸钾晶体析出,因为硝酸钾的溶解度随温度的升高而增大;故A.冰块溶解吸热会使溶液的温度降低,C.硝酸铵溶于水会吸收热量是溶液的温度降低,二者都可以间接使硝酸钾通过降温而结晶析出;
故选AC;
(3)步骤2恰好饱和,故为饱和溶液;从而也说明溶液①是不饱和溶液;步骤3是在步骤2的基础上继续加溶质,不能继续溶解,故为饱和溶液;步骤4只是加热,看到全部溶解,可能是饱和溶液,也可能是不饱和溶液;步骤5又降温到20℃,故为饱和溶液;步骤6在饱和溶液的基础上蒸发10g水,恢复至20℃,仍为饱和溶液,析出晶体的质量是3.16g;因为②③⑤⑥的溶液都是20℃时的硝酸钾饱和溶液,溶解度相等,故溶质质量分数也相等;
故答案为:
①; ②③⑤⑥; 3.16g;
(4)①10ml98%的浓硫酸中含硫酸的质量是:1.82g/ml×10ml×98%=17.8g;
故答案为:
①17.8;
②参加反应的硫酸的质量是:17.8g×
| 10mL |
| 100mL |
设 10ml稀硫酸与锌完全反应消耗锌的质量为X
Zn+H2SO4=ZnSO4+H2↑
65 98
X 1.78g
| 65 |
| X |
| 98 |
| 1.78g |
解之:X=1.2g
答:消耗金属锌的质量是1.2g.
点评:此题考查了学生实验探究和利用方程式解题的能力,和利用控制变量法灵活分析问题、解决问题的能力,抓住相关数值进行细致分析即可.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
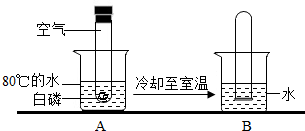 (2013?焦作模拟)某同学做了一个趣味实验(装置气密性良好).整个实验过程如图所示:待试管冷却至室温,在水中取下胶塞,试管中液面上升(如图B所示).请用理化知识解释试管中液面上升的原因
(2013?焦作模拟)某同学做了一个趣味实验(装置气密性良好).整个实验过程如图所示:待试管冷却至室温,在水中取下胶塞,试管中液面上升(如图B所示).请用理化知识解释试管中液面上升的原因