摘要:12.写出化学式3H2SO4中2.3.4所表示的含义: .
网址:http://m.1010jiajiao.com/timu3_id_27674[举报]
28、某课外兴趣小组的同学为了探究金属X、Y、Z三种金属的活动性顺序,设计并完成了下图所示的二组实验:
实验一:把金属X、Y、Z三种金属分别放入溶液中
请你根据他们所做的实验回答:
(1)Z与硫酸反应后,生成+3价金属离子,写出实验③的化学方程式:
(2)通过上述实验,你认为上述三种金属最活泼是:
实验二:把X、Y两种金属丝放入硝酸银溶液中
(3)通过实验事实得出X、Y、Z金属活动性由强到弱的顺序为
实验三:小组同学选择“Z丝和硫酸反应的快慢与什么因素有关”的课题开展探究.下表是他们分别用相同质量的Z丝和足量稀硫酸反应的三组实验数据:
(4)实验⑦和⑧表明:该反应快慢与
(5)能表明硫酸浓度对反应快慢有影响的实验编号是:
(6)如果实验⑥中硫酸的质量分数改为4%,请推出Z丝消失的时间(用t表示)的取值范围
(7)该实验除了用Z丝消失的时间来衡量反应的快慢外,你还能提出新的方法来衡量反应的快慢吗?方法
查看习题详情和答案>>
实验一:把金属X、Y、Z三种金属分别放入溶液中
| 实验 | 实验步骤 | 实验现象 |
| ① | 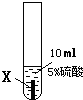 |
X片表面无明显变化 |
| ② | 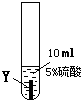 |
Y片表面无明显变化 |
| ③ | 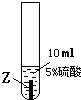 |
Z片溶解,表面有无色氢气产生,溶液最终为无色 |
(1)Z与硫酸反应后,生成+3价金属离子,写出实验③的化学方程式:
2Z+3H2SO4=Z2(SO4)3+3H2↑
.(2)通过上述实验,你认为上述三种金属最活泼是:
Z
.实验二:把X、Y两种金属丝放入硝酸银溶液中
| 实验 | 实验步骤 | 实验现象 |
| ④ | 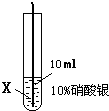 |
在X丝表面有银白色的固体析出 |
| ⑤ |  |
在Y丝表面没有明显现象 |
Z>X>Y
.实验三:小组同学选择“Z丝和硫酸反应的快慢与什么因素有关”的课题开展探究.下表是他们分别用相同质量的Z丝和足量稀硫酸反应的三组实验数据:
| 实验编号 | 硫酸的质量分数/% | 反应的温度 | Z丝消失的时间/S |
| ⑥ | 3 | 20 | 500 |
| ⑦ | 6 | 20 | 300 |
| ⑧ | 6 | 30 | 80 |
温度
有关(5)能表明硫酸浓度对反应快慢有影响的实验编号是:
⑥
和⑦
(6)如果实验⑥中硫酸的质量分数改为4%,请推出Z丝消失的时间(用t表示)的取值范围
300S<t<500S
_(7)该实验除了用Z丝消失的时间来衡量反应的快慢外,你还能提出新的方法来衡量反应的快慢吗?方法
用排水法收集等体积的一瓶氢气所需时间的多少来衡量
.(2013?江宁区二模)同学们依据物质类别和物质中某种元素的化合价构建了初中化学常见物质间的转化关系坐标图(图中“→”表示物质间的转化).请回答下列问题:

(1)工业上可用化合反应来制备B,且反应时放出大量热,B的俗称为
(2)E的固体露置在空气中一段时间后质量会增加,其原因是
(3)H、G均可与F溶液反应,分别生成含该金属元素的两种盐溶液,则G与F溶液反应的化学方程式为
(4)在B溶液中加入一定量D溶液,过滤后取滤液,滴入过量F溶液,无明显现象,则滤液中的溶质是(写出所有可能)
(5)A~M九种物质中能与F溶液反应的物质有
查看习题详情和答案>>

(1)工业上可用化合反应来制备B,且反应时放出大量热,B的俗称为
熟石灰或消石灰
熟石灰或消石灰
.(2)E的固体露置在空气中一段时间后质量会增加,其原因是
吸水潮解,与二氧化碳反应变质
吸水潮解,与二氧化碳反应变质
.(3)H、G均可与F溶液反应,分别生成含该金属元素的两种盐溶液,则G与F溶液反应的化学方程式为
Fe2O3+6HCl=2FeCl3+3H2O或Fe2O3+3H2SO4=Fe2(SO4)3+3H2O
Fe2O3+6HCl=2FeCl3+3H2O或Fe2O3+3H2SO4=Fe2(SO4)3+3H2O
.(4)在B溶液中加入一定量D溶液,过滤后取滤液,滴入过量F溶液,无明显现象,则滤液中的溶质是(写出所有可能)
NaOH或NaOH和Ca(OH)2
NaOH或NaOH和Ca(OH)2
.(5)A~M九种物质中能与F溶液反应的物质有
7
7
种.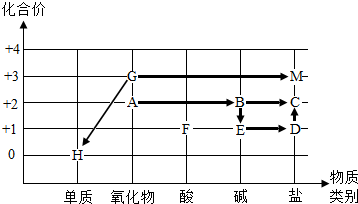 (2013?朝阳区一模)同学们依据物质类别和物质中某种元素的化合价构建了初中化学常见物质间的转化关系坐标图(图中“→”表示物质间的转化).
(2013?朝阳区一模)同学们依据物质类别和物质中某种元素的化合价构建了初中化学常见物质间的转化关系坐标图(图中“→”表示物质间的转化).请回答下列问题:
(1)工业上可用化合反应来制备B,且反应时放出大量热,B的俗称为
熟石灰或消石灰
熟石灰或消石灰
.(2)E的固体露置在空气中一段时间后质量会增加,其原因是
吸水潮解,与二氧化碳反应变质
吸水潮解,与二氧化碳反应变质
.(3)H、G均可与F溶液反应,分别生成含该金属元素的两种盐溶液,则G与F溶液反应的化学方程式为
Fe2O3+6HCl=2FeCl3+3H2O或Fe2O3+3H2SO4=Fe2(SO4)3+3H2O
Fe2O3+6HCl=2FeCl3+3H2O或Fe2O3+3H2SO4=Fe2(SO4)3+3H2O
.(4)在B溶液中加入一定量D溶液,过滤后取滤液,滴入过量F溶液,无明显现象,则滤液中的溶质是(写出所有可能)
NaOH或NaOH和Ca(OH)2
NaOH或NaOH和Ca(OH)2
.(5)已知金属铝可与E溶液反应生成偏铝酸钠(NaAlO2)和一种最轻的气体,写出该反应的化学方程式
2Al+2NaOH+2H2O=2NaAlO2+3H2↑
2Al+2NaOH+2H2O=2NaAlO2+3H2↑
.(6)A~M九种物质中能与F溶液反应的物质有
7
7
种.(2013?雅安)废铁屑的主要成份是铁,同时还有少量铁锈(Fe2O3),动物饲料硫酸亚铁的生产工艺之一如下图所示:
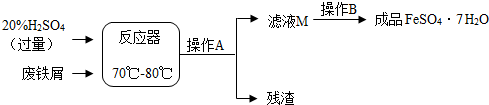
(1)在反应器中发生反应的化学方程式除Fe2(SO4)3+Fe=3FeSO4外还有:
(2)滤液M中肯定含有的溶质的化学式是
(3)在实验室中完成操作A的玻璃仪器有玻璃棒、烧杯和
(4)滤液M经过操作B可得硫酸亚铁晶体(FeSO4?7H2O).已知硫酸亚铁的溶解度和析出晶体的组成如下表:
根据溶解度表,硫酸亚铁晶体(FeSO4?7H2O)冷却结晶温度最高不超过
(5)在化学反应中,若有元素化合价变化的反应定义为氧化还原反应.下列反应类型肯定是氧化还原反应的是
A.化合反应B.置换反应C.分解反应D.复分解反应
在氧化还原反应中,若有元素的化合价升高,必有元素的化合价降低,且元素化合价升降总数相等.
将无水硫酸亚铁(FeSO4)隔绝空气加强热,生成产物有三氧化二铁和其它氧化物,试写出该反应的化学方程式
查看习题详情和答案>>

(1)在反应器中发生反应的化学方程式除Fe2(SO4)3+Fe=3FeSO4外还有:
Fe+H2SO4═FeSO4+H2↑;Fe2O3+3H2SO4═Fe2(SO4)3+3H2O
Fe+H2SO4═FeSO4+H2↑;Fe2O3+3H2SO4═Fe2(SO4)3+3H2O
;(2)滤液M中肯定含有的溶质的化学式是
FeSO4、H2SO4
FeSO4、H2SO4
;(3)在实验室中完成操作A的玻璃仪器有玻璃棒、烧杯和
漏斗
漏斗
;(4)滤液M经过操作B可得硫酸亚铁晶体(FeSO4?7H2O).已知硫酸亚铁的溶解度和析出晶体的组成如下表:
| 温度/℃ | 0 | 10 | 30 | 40 | 50 | 60 | 64 | 70 | 80 | 90 | |
| 溶解度/g | 15.6 | 20.5 | 33.0 | 40.4 | 48.8 | 55.0 | 55.3 | 50.6 | 43.7 | 37.2 | |
| 析出晶体 | FeSO4?7H2O | FeSO4?4H2O | FeSO4?H2O | ||||||||
64
64
℃;(5)在化学反应中,若有元素化合价变化的反应定义为氧化还原反应.下列反应类型肯定是氧化还原反应的是
B
B
(填字母编号);A.化合反应B.置换反应C.分解反应D.复分解反应
在氧化还原反应中,若有元素的化合价升高,必有元素的化合价降低,且元素化合价升降总数相等.
将无水硫酸亚铁(FeSO4)隔绝空气加强热,生成产物有三氧化二铁和其它氧化物,试写出该反应的化学方程式
2FeSO4
Fe2O3+SO2↑+SO3↑
| ||
2FeSO4
Fe2O3+SO2↑+SO3↑
.
| ||
摩尔盐(硫酸亚铁铵晶体)具有重要用途,下图为制取摩尔盐过程的示意图.请回答下列问题:
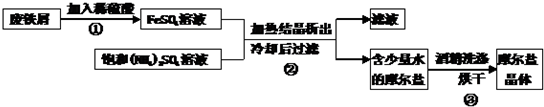
(1)实验前,先用碳酸钠溶液浸泡废铁屑表面油渍.碳酸钠溶液可除去油渍是因为碳酸钠溶液的pH
(2)废铁屑的主要成分是铁,同时含有少量氧化铁.步骤①中有多个化学反应,请写出其中2个反应的化学方程式:
(3)根据步骤③可知,摩尔盐
(4)步骤②所得滤液含有未反应的FeSO4、(NH4)2SO4,可采用如下流程回收利用.
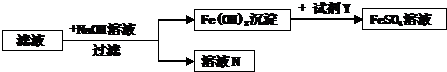
滤液N中一定含有的溶质是
查看习题详情和答案>>

(1)实验前,先用碳酸钠溶液浸泡废铁屑表面油渍.碳酸钠溶液可除去油渍是因为碳酸钠溶液的pH
>
>
7(填“>”、“<”或“=”).(2)废铁屑的主要成分是铁,同时含有少量氧化铁.步骤①中有多个化学反应,请写出其中2个反应的化学方程式:
Fe+H2SO4=FeSO4+H2↑
Fe+H2SO4=FeSO4+H2↑
、Fe2O3+3H2SO4=Fe2(SO4)3+3H2O
Fe2O3+3H2SO4=Fe2(SO4)3+3H2O
.(3)根据步骤③可知,摩尔盐
不能
不能
溶解于酒精(填“能”或“不能”).(4)步骤②所得滤液含有未反应的FeSO4、(NH4)2SO4,可采用如下流程回收利用.

滤液N中一定含有的溶质是
硫酸钠
硫酸钠
,试剂Y是硫酸(或H2SO4)
硫酸(或H2SO4)
.