摘要:11.在一定温度下.反应2NO2 N2O4在一定体积中达平衡的标志是( ) A.混合气颜色不随时间的变化 B.数值上v(NO2生成)=2v(N2O4消耗) C.单位时间内反应物减少的分子数等于生成物增加的分子数 D.压强不随时间的变化而变化
网址:http://m.1010jiajiao.com/timu3_id_275100[举报]
某温度下,反应N2O4(g)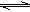 2NO2(g)(正反应吸热)在密闭容器中达到平衡,下列说法中不正确的是( )。
2NO2(g)(正反应吸热)在密闭容器中达到平衡,下列说法中不正确的是( )。
A.加压(体积变小),将使正逆反应速率均加快
B.保持体积不变,加入少许NO2的瞬间将使正反应速率减小
C.保持体积不变,加入一定量N2O4,再达到平衡时,颜色变深
D.保持体积不变,升高温度,再达到平衡时,颜色变深 查看习题详情和答案>>
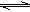 2NO2(g)(正反应吸热)在密闭容器中达到平衡,下列说法中不正确的是( )。
2NO2(g)(正反应吸热)在密闭容器中达到平衡,下列说法中不正确的是( )。A.加压(体积变小),将使正逆反应速率均加快
B.保持体积不变,加入少许NO2的瞬间将使正反应速率减小
C.保持体积不变,加入一定量N2O4,再达到平衡时,颜色变深
D.保持体积不变,升高温度,再达到平衡时,颜色变深 查看习题详情和答案>>
在一定温度下,向容积不变的密闭容器中充入a mol NO2,发生如下反应:2NO2(g)?N2O4(g);△H<0.达平衡后再向容器中充入a mol NO2,再次达到平衡后,与原平衡比较,下列叙述不正确的是( )
查看习题详情和答案>>
 在一定条件下,向一带活塞的密闭容器中充入2mol NO2,发生下列反应2NO2(g)?N2O4(g)△H<0,达到平衡状态后,在t1时刻改变条件,化学反应速率随时间变化关系如图.下列对t1时刻改变条件的推测中正确的是( )
在一定条件下,向一带活塞的密闭容器中充入2mol NO2,发生下列反应2NO2(g)?N2O4(g)△H<0,达到平衡状态后,在t1时刻改变条件,化学反应速率随时间变化关系如图.下列对t1时刻改变条件的推测中正确的是( )
查看习题详情和答案>>
 在一定温度下,体积为2L的密闭容器中,NO2和N2O4之间发生反应:N2O4(g)
在一定温度下,体积为2L的密闭容器中,NO2和N2O4之间发生反应:N2O4(g) 2NO2 (g),如图所示.
2NO2 (g),如图所示.(1)曲线
Y
Y
(填“X”或“Y”)表示NO2的物质的量随时间的变化曲线.(2)若升高温度,则v(正)
加快
加快
,v(逆)加快
加快
(填“加快”或“减慢”).(3)若上述反应在甲、乙两个相同容器内同时进行,分别测得甲
中v(NO2)=0.3mol?L-1?min-1,乙中v (N2O4)=0.2mol?L-1?min-1,则
乙
乙
中反应更快.(4)在0到1min中内用X表示该反应的速率是
0.1mol?(L?min)-1
0.1mol?(L?min)-1
,该反应达最大限度时,Y的转化率60%
60%
,反应开始时与反应达平衡状态时的压强之比为14:11
14:11
.(5)下列描述能表示反应达平衡状态的是
BCD
BCD
.A.容器中X与Y的物质的量相等B.容器内气体的颜色不再改变
C.容器的压强保持一定D.容器内气体的平均相对分子质量不再改变
E.2v(X)=v(Y)
(6)若1mol N2O4完全转化为2mol NO2 (g)时吸收QKJ的热量,在一密闭容器中充入2mol NO2 (g),容器内温度
升高
升高
(升高、降低或不变).达到反应限度时反应产生的热量小于
小于
QKJ(大于、小于或等于).