题目内容
 在一定温度下,体积为2L的密闭容器中,NO2和N2O4之间发生反应:N2O4(g)
在一定温度下,体积为2L的密闭容器中,NO2和N2O4之间发生反应:N2O4(g) 2NO2 (g),如图所示.
2NO2 (g),如图所示.(1)曲线
Y
Y
(填“X”或“Y”)表示NO2的物质的量随时间的变化曲线.(2)若升高温度,则v(正)
加快
加快
,v(逆)加快
加快
(填“加快”或“减慢”).(3)若上述反应在甲、乙两个相同容器内同时进行,分别测得甲
中v(NO2)=0.3mol?L-1?min-1,乙中v (N2O4)=0.2mol?L-1?min-1,则
乙
乙
中反应更快.(4)在0到1min中内用X表示该反应的速率是
0.1mol?(L?min)-1
0.1mol?(L?min)-1
,该反应达最大限度时,Y的转化率60%
60%
,反应开始时与反应达平衡状态时的压强之比为14:11
14:11
.(5)下列描述能表示反应达平衡状态的是
BCD
BCD
.A.容器中X与Y的物质的量相等B.容器内气体的颜色不再改变
C.容器的压强保持一定D.容器内气体的平均相对分子质量不再改变
E.2v(X)=v(Y)
(6)若1mol N2O4完全转化为2mol NO2 (g)时吸收QKJ的热量,在一密闭容器中充入2mol NO2 (g),容器内温度
升高
升高
(升高、降低或不变).达到反应限度时反应产生的热量小于
小于
QKJ(大于、小于或等于).分析:(1)根据物质的量的变化量之比等于计量数之比分析;
(2)根据温度对反应速率的影响分析;
(3)根据反应速率之比等于化学计量数之比比较;
(4)根据v=
计算反应速率,结合图象计算相关物理量;
(5)化学反应到达平衡状态时,正逆反应速率相等,各物质的浓度不变,由此衍生的一些物理量不变,以此进行判断;
(6)从平衡移动和可逆反应的特征分析.
(2)根据温度对反应速率的影响分析;
(3)根据反应速率之比等于化学计量数之比比较;
(4)根据v=
| △c |
| △t |
(5)化学反应到达平衡状态时,正逆反应速率相等,各物质的浓度不变,由此衍生的一些物理量不变,以此进行判断;
(6)从平衡移动和可逆反应的特征分析.
解答:解:(1)由方程式N2O4(g) 2NO2 (g),可知反应中NO2 的物质的量变化较大,则Y表示NO2的物质的量随时间的变化曲线,故答案为:Y;
2NO2 (g),可知反应中NO2 的物质的量变化较大,则Y表示NO2的物质的量随时间的变化曲线,故答案为:Y;
(2)温度升高,正逆反应速率都增大,故答案为:加快;加快;
(3)甲中v(NO2)=0.3mol?L-1?min-1,乙中v (N2O4)=0.2mol?L-1?min-1,v(NO2)=2v(N2O4)=0.4mol?L-1?min-1,
则乙反应较快,故答案为:乙;
(4)v(X)=
=0.1mol?(L?min)-1,
该反应达最大限度时,Y的转化率为:
×100%=60%,
开始时:n(X)+n(Y)=0.4mol+1mol=1.4mol,
平衡时:n(X)+n(Y)=0.7mol+0.4mol=1.1mol,
在相同条件下,气体的压强之比等于物质的量之比,
则反应开始时与反应达平衡状态时的压强之比为1.4mol:1.1mol=14:11,
故答案为:0.1mol?(L?min)-1;60%;14:11;
(5)A.容器中X与Y的物质的量相等,不能说明达到平衡状态,故A错误;
B.容器内气体的颜色不再改变,说明反应物的浓度不变,达到平衡状态,故B正确;
C.容器的压强保持一定,说明各物质的物质的量不再改变,达到平衡状态,故C正确;
D.容器内气体的平均相对分子质量不再改变,说明各物质的物质的量不再改变,达到平衡状态,故D正确;
E.无论是否达到平衡状态,都存在2v(X)=v(Y),故E错误.
故答案为:BCD;
(6)若1mol N2O4完全转化为2mol NO2 (g)时吸收QKJ的热量,则NO2生成N2O4为放热反应,在一密闭容器中充入2mol NO2 (g),容器内温度升高,因该反应为可逆反应,则2molNO2不能完全转化为N2O4,达到反应限度时反应产生的热量小于
QKJ,故答案为:升高;小于.
 2NO2 (g),可知反应中NO2 的物质的量变化较大,则Y表示NO2的物质的量随时间的变化曲线,故答案为:Y;
2NO2 (g),可知反应中NO2 的物质的量变化较大,则Y表示NO2的物质的量随时间的变化曲线,故答案为:Y;(2)温度升高,正逆反应速率都增大,故答案为:加快;加快;
(3)甲中v(NO2)=0.3mol?L-1?min-1,乙中v (N2O4)=0.2mol?L-1?min-1,v(NO2)=2v(N2O4)=0.4mol?L-1?min-1,
则乙反应较快,故答案为:乙;
(4)v(X)=
| ||
| 1min |
该反应达最大限度时,Y的转化率为:
| 1mol-0.4mol |
| 1mol |
开始时:n(X)+n(Y)=0.4mol+1mol=1.4mol,
平衡时:n(X)+n(Y)=0.7mol+0.4mol=1.1mol,
在相同条件下,气体的压强之比等于物质的量之比,
则反应开始时与反应达平衡状态时的压强之比为1.4mol:1.1mol=14:11,
故答案为:0.1mol?(L?min)-1;60%;14:11;
(5)A.容器中X与Y的物质的量相等,不能说明达到平衡状态,故A错误;
B.容器内气体的颜色不再改变,说明反应物的浓度不变,达到平衡状态,故B正确;
C.容器的压强保持一定,说明各物质的物质的量不再改变,达到平衡状态,故C正确;
D.容器内气体的平均相对分子质量不再改变,说明各物质的物质的量不再改变,达到平衡状态,故D正确;
E.无论是否达到平衡状态,都存在2v(X)=v(Y),故E错误.
故答案为:BCD;
(6)若1mol N2O4完全转化为2mol NO2 (g)时吸收QKJ的热量,则NO2生成N2O4为放热反应,在一密闭容器中充入2mol NO2 (g),容器内温度升高,因该反应为可逆反应,则2molNO2不能完全转化为N2O4,达到反应限度时反应产生的热量小于
QKJ,故答案为:升高;小于.
点评:本题考查较为综合,题目难度中等,注意把握化学反应速率以及化学平衡的基本知识即可解答该题.

练习册系列答案
相关题目
 二甲醚(CH3OCH3)具有优良的燃烧性能,被称为21世纪的“清洁能源”.一步法合成二甲醚是以合成气(CO/H2)为原料,在一定温度、压强和催化剂作用下进行,反应器中发生了下列反应:
二甲醚(CH3OCH3)具有优良的燃烧性能,被称为21世纪的“清洁能源”.一步法合成二甲醚是以合成气(CO/H2)为原料,在一定温度、压强和催化剂作用下进行,反应器中发生了下列反应:
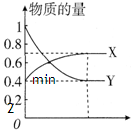
 2NO2 (g),如图所示.
2NO2 (g),如图所示.