网址:http://m.1010jiajiao.com/timu3_id_275008[举报]
A.《化学与生活》
(1)现有下列五种物质:(a)食盐 (b)食醋 (c)苹果汁 (d)葡萄糖 (e)青霉素,请按下列要求填空(填序号).
富含维生素C的是
(2)防治环境污染,改善生态环境已成为全球的共识.
①空气质量报告的各项指标可以反映出各地空气的质量.下列气体已纳入我国空气质量报告的是
a.CO2 b.N2 c.NO2
②垃圾应分类收集.导致“白色污染”的生活垃圾应放置于贴有
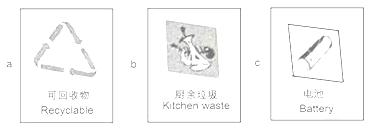
③工业废水需处理达标后才能排放.下列废水处理的方法合理的是
a.用中和法除去废水中的酸
b.用混凝剂除去废水中的重金属离子
c.用氯气除去废水中的悬浮物
(3)材料是人类赖以生存的重要物质基础,而化学是材料科学发展的基础.请填写下列空格.
①生活中的陶瓷、水泥和
②在原子反应堆中得以广泛应用的钠钾合金在常温下呈液态,说明合金的熔点比其成分金属的熔点
③下列对金属制品采取的防护方法不正确的是
A.在电线的外面包上一层塑料层 B.在自行车钢圈上镀上一层金属铬
C.在海轮的铁制外壳上焊上铜块
(4)某肉制品包装上印有相关配料:精选瘦肉、食盐、亚硝酸钠、苯甲酸钠.其中属于调味剂的是
B.《有机化学基础》(我校学生统一不选做)
(1)(3分)根据结构对有机物进行分类,有助于对其性质的掌握.
①下列有机物属于芳香烃的是
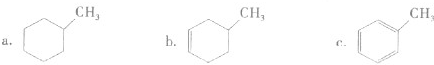
②下列有机物属于酚类的是
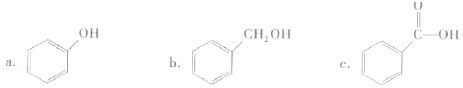
③下列有机物属于糖类的是
a.油脂 b.纤维素 c.蛋白质
(2)化合物X的结构简式为:
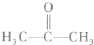
①X的核磁共振氢谱图(H核磁共振谱图)上有
②X的一种同分异构体Y能发生银镜反应,请写出Y的结构简式:
③X的另一种同分异构体z的结构简式为H2C═CHCH2OH,请写出Z与Br2发生加成反应的化学方程式:
(3)2010年上海世博会充分体现了绿色生活理念,节能环保材料在园区内随处可见.如一次性餐盒是由一种生物可降解的高分子合成材料制得.其结构简式如下:
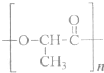
①该高分子材料是由一种单体通过


②若两分子的该单体发生反应,既可能得到环状化合物M,也可能得到链状化合物N.其结构简式如下:
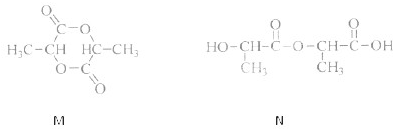
请用两种方法鉴别M和N.方法一:
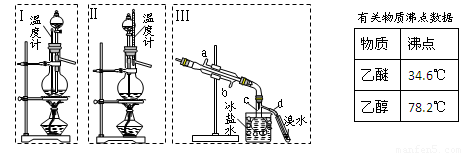
(本题共12分)乙醚极易挥发、微溶于水、是良好的有机溶剂。乙醇与浓硫酸的混合物在不同温度下反应能生成乙烯或乙醚。某实验小组用下图装置制取乙醚和乙烯。
1.制乙醚:在蒸馏烧瓶中先加入10mL乙醇,慢慢加入10 mL浓硫酸,冷却,固定装置。加热到140℃时,打开分液漏斗活塞,继续滴加10 mL乙醇,并保持140℃,此时烧瓶c中收集到无色液体。
(1)Ⅰ和Ⅱ是反应发生装置,应该选择______(选答“Ⅰ”或“Ⅱ”)与装置Ⅲ相连。
(2)乙醇通过分液漏斗下端连接的长导管插入到液面下加入,目的有二,一是使反应物充分混合,二是_________________。
2.Ⅲ中水冷凝管的进水口是______(选答“a”或“b”)。冰盐水的作用是___________。
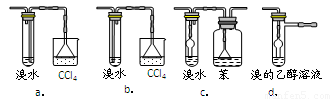
3.有同学认为以上装置还不够完善,一是溴水可能倒吸,二是尾气弥漫在空气中遇明火危险。该同学设计了以下几种装置与导管d连接,你认为合理的是(选填编号)_______。
4.反应一段时间后,升温到170℃,观察到反应物变为黑色,溴水褪色。写出实验过程中所有生成气体的反应方程式____________________________。
5.实验中收集到的乙醚产品中可能含有多种杂质。某同学设计了以下提纯方案:
(1)分液步骤除去产品中的酸性杂质,则X可以是________________。
(2)蒸馏操作可除去的杂质是____________。
6.工业乙醚常因接触空气和光而被氧化,含有少量过氧化物,除去过氧化物的试剂及操作分别是(选填编号)______________。
a.CCl4、萃取 b.Na2SO3溶液、分液
c.Na2SO4溶液、过滤 d.酸化的FeSO4溶液、分液
查看习题详情和答案>>
(本题共12分)乙醚极易挥发、微溶于水、是良好的有机溶剂。乙醇与浓硫酸的混合物在不同温度下反应能生成乙烯或乙醚。某实验小组用下图装置制取乙醚和乙烯。
1.制乙醚:在蒸馏烧瓶中先加入10 mL乙醇,慢慢加入10 mL浓硫酸,冷却,固定装置。加热到140℃时,打开分液漏斗活塞,继续滴加10 mL乙醇,并保持140℃,此时烧瓶c中收集到无色液体。
(1)Ⅰ和Ⅱ是反应发生装置,应该选择______(选答“Ⅰ”或“Ⅱ”)与装置Ⅲ相连。
(2)乙醇通过分液漏斗下端连接的长导管插入到液面下加入,目的有二,一是使反应物充分混合,二是_________________。
2.Ⅲ中水冷凝管的进水口是______(选答“a”或“b”)。冰盐水的作用是___________。
3.有同学认为以上装置还不够完善,一是溴水可能倒吸,二是尾气弥漫在空气中遇明火危险。该同学设计了以下几种装置与导管d连接,你认为合理的是(选填编号)_______。
4.反应一段时间后,升温到170℃,观察到反应物变为黑色,溴水褪色。写出实验过程中所有生成气体的反应方程式____________________________。
5.实验中收集到的乙醚产品中可能含有多种杂质。某同学设计了以下提纯方案:
(1)分液步骤除去产品中的酸性杂质,则X可以是________________。
(2)蒸馏操作可除去的杂质是____________。
6.工业乙醚常因接触空气和光而被氧化,含有少量过氧化物,除去过氧化物的试剂及操作分别是(选填编号)______________。
a.CCl4、萃取 b.Na2SO3溶液、分液
c.Na2SO4溶液、过滤 d.酸化的FeSO4溶液、分液
(本题共12分)乙醚极易挥发、微溶于水、是良好的有机溶剂。乙醇与浓硫酸的混合物在不同温度下反应能生成乙烯或乙醚。某实验小组用下图装置制取乙醚和乙烯。
1.制乙醚:在蒸馏烧瓶中先加入10 mL乙醇,慢慢加入10 mL浓硫酸,冷却,固定装置。加热到140℃时,打开分液漏斗活塞,继续滴加10 mL乙醇,并保持140℃,此时烧瓶c中收集到无色液体。
(1)Ⅰ和Ⅱ是反应发生装置,应该选择______(选答“Ⅰ”或“Ⅱ”)与装置Ⅲ相连。
(2)乙醇通过分液漏斗下端连接的长导管插入到液面下加入,目的有二,一是使反应物充分混合,二是_________________。
2.Ⅲ中水冷凝管的进水口是______(选答“a”或“b”)。冰盐水的作用是___________。
3.有同学认为以上装置还不够完善,一是溴水可能倒吸,二是尾气弥漫在空气中遇明火危险。该同学设计了以下几种装置与导管d连接,你认为合理的是(选填编号)_______。
4.反应一段时间后,升温到170℃,观察到反应物变为黑色,溴水褪色。写出实验过程中所有生成气体的反应方程式____________________________。
5.实验中收集到的乙醚产品中可能含有多种杂质。某同学设计了以下提纯方案:

(1)分液步骤除去产品中的酸性杂质,则X可以是________________。
(2)蒸馏操作可除去的杂质是____________。
6.工业乙醚常因接触空气和光而被氧化,含有少量过氧化物,除去过氧化物的试剂及操作分别是(选填编号)______________。
a.CCl4、萃取 b.Na2SO3溶液、分液
c.Na2SO4溶液、过滤 d.酸化的FeSO4溶液、分液
查看习题详情和答案>>
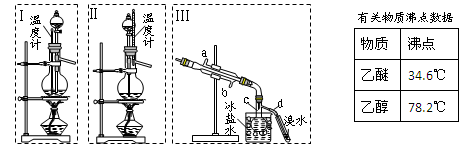
1.制乙醚:在蒸馏烧瓶中先加入10 mL乙醇,慢慢加入10 mL浓硫酸,冷却,固定装置。加热到140℃时,打开分液漏斗活塞,继续滴加10 mL乙醇,并保持140℃,此时烧瓶c中收集到无色液体。
(1)Ⅰ和Ⅱ是反应发生装置,应该选择______(选答“Ⅰ”或“Ⅱ”)与装置Ⅲ相连。
(2)乙醇通过分液漏斗下端连接的长导管插入到液面下加入,目的有二,一是使反应物充分混合,二是_________________。
2.Ⅲ中水冷凝管的进水口是______(选答“a”或“b”)。冰盐水的作用是___________。
3.有同学认为以上装置还不够完善,一是溴水可能倒吸,二是尾气弥漫在空气中遇明火危险。该同学设计了以下几种装置与导管d连接,你认为合理的是(选填编号)_______。
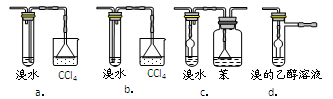
4.反应一段时间后,升温到170℃,观察到反应物变为黑色,溴水褪色。写出实验过程中所有生成气体的反应方程式____________________________。
5.实验中收集到的乙醚产品中可能含有多种杂质。某同学设计了以下提纯方案:
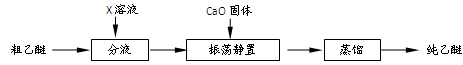
(1)分液步骤除去产品中的酸性杂质,则X可以是________________。
(2)蒸馏操作可除去的杂质是____________。
6.工业乙醚常因接触空气和光而被氧化,含有少量过氧化物,除去过氧化物的试剂及操作分别是(选填编号)______________。
a.CCl4、萃取 b.Na2SO3溶液、分液
c.Na2SO4溶液、过滤 d.酸化的FeSO4溶液、分液