网址:http://m.1010jiajiao.com/timu3_id_273752[举报]
①将少量此化合物加入到适量氢氧化钠溶液中,加热,产生使湿润的红色石蕊试纸变蓝的气体;
②将少量此化合物溶于水,加入硝酸钡溶液,产生能溶于稀硝酸的白色沉淀.
则该物质是( )
| A、NH4Cl | B、(NH4)2CO3 | C、NaCl | D、K2SO4 |
Ⅰ化合物A、B、C、D均为一元含氧衍生物,如图中涉及的7个转化均为中学化学中的常见反应。
(1) B的分子中一定含有的官能团是______(填名称)。
C 的分子中一定含有的官能团是______(填结构简式)。
(2) 指出反应类型:A→B__________________反应;
C→D__________________反应;
Ⅱ.(15分)结构的研究是有机化学最重要的研究领域。某有机物X(C12H13O6Br)分子中含有多种官能团,其结构简式如下:(其中Ⅰ、Ⅱ为未知部分的结构)。
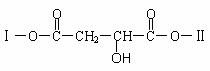
为推测X的分子结构,进行如下图转化:
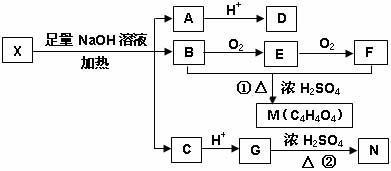
已知向D的水溶液中滴入FeCl3溶液显紫色,对D的结构进行光谱分析,在氢核磁共振谱上显示只有两种信号(即只有两种不同性质的氢原子)。M、N互为同分异构体,M中含有一个六原子环,N能使溴的四氯化碳溶液褪色,G能与NaHCO3溶液反应。请回答:
(1)G分子所含官能团的名称是__________________;
(2)D不可以发生的反应有(选填序号)_____________;
①加成反应 ②消去反应 ③氧化反应 ④取代反应
(3)写出右图转化中反应①和②的化学方程式
①B+F→M_________________________________________________;
②G→N______________________________________________________;
(4)已知向X中加入FeCl3溶液,能发生显色反应,则X的结构简式是__________________;该结构的1mol X与足量的NaOH溶液作用,最多可消耗NaOH___________mol。
(5)有一种化工产品的中间体W与G互为同分异构体,W的分子中只含有羧基、羟基和醛基三种官能团,且同一个碳原子上不能同时连有两个羟基,则W的分子结构有_________种,写出任意一种的结构简式_______________。
查看习题详情和答案>>
Ⅰ、有如图1所示的实验装置.
(1)若用石墨电极电解NaHCO3溶液,Y电极上产生的气体是
(2)如要在铁上镀铜,则X电极的材料是
Ⅱ、某电镀铜厂有两种废水需要处理,一种废水中含有CN-离子,另一种废水中含Cr2O72-离子.该厂拟定如图2所示的废水处理流程.
回答以下问题:
(1)②中使用的NaClO溶液呈碱性,原因是
(2)③中反应时,每0.4mol Cr2O72-转移2.4mole-,该反应的离子方程式为
(3)取少量待检水样于试管中,加入过量NaOH溶液,有蓝色沉淀生成.向上述有蓝色沉淀的悬浊液中加入Na2S溶液,有黑色沉淀生成,且蓝色沉淀逐渐减少.请你使用化学用语,结合必要的文字说明分析其过程
Ⅲ、工业可用电解法来处理含Cr2O72-废水.
(1)Fe2+与酸性溶液中的Cr2O72-反应的离子方程式是
(2)实验室利用如图3所示模拟处理含Cr2O72-的废水(废水中加入适量NaCl以增加溶液的导电性),在阴极区得到金属氢氧化物沉淀.用平衡移动原理解释沉淀出现在阴极附近的原因
(3)用电解法处理该溶液中 0.01mol Cr2O72-时,得到沉淀的质量是
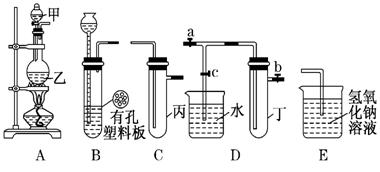
某化学兴趣小组的同学利用下图所示实验装置进行实验(图中a、b、c表示止水夹).
请按要求填空:
(1)仪器甲的名称是__________________;
(2)利用B装置可制取的气体有_________;(写出一种即可).
(3) A、C、E相连后![]() 的装置可用于制取Cl2并进行相关的性质实验.
的装置可用于制取Cl2并进行相关的性质实验.
若在丙中加入适量水,即可制得氯水.将所得氯水分为两份,进行Ⅰ、Ⅱ两个实验,实验操作、现象、结论如下:
| 实验序号 | 实验操作 | 现象 | 结论 |
| Ⅰ | 将氯水滴入品红溶液 | 溶液褪色 | 氯气与水反应的 产物有漂白性 |
| Ⅱ | 氯水中加入 碳酸氢钠粉末 | 有无色气泡产生 | 氯气与水反应的 产物具有酸性 |
请你评价实验Ⅰ、Ⅱ的结论是否合理?若不合理的请直接说明理由
实验Ⅰ___________________________________________________
实验Ⅱ_______________________![]() _____________________________.
_____________________________.
(4)B、D、E装置相连后,在B中盛装浓硝酸和铜片(放在有孔塑料板上),可制得并进行NO2有关实验.
①欲用D装置验证NO2与水的反应,其操作步骤为:先关闭止水夹a和b,再打开止水夹c,使烧杯中的水进入试管丁的操作是_______.
②试管丁中集满NO2,再与水充分反应后,向试管内缓缓通入一定量的氧气,直到试管内全部充满水,则所得溶液中溶质的物质的量浓度是_______mol/L(气体按标准状况计算).
查看习题详情和答案>>(14分)某化学课外研究小组拟对一种焰火原料(由两种短周期中的常见金属元素的单质组成的合金粉末)进行探究,请完成下列探究报告。
【探究目的】探究该焰火原料的成分
【资料检索】
(1)Mg2+检验方法:取2滴待测液,加入2滴2 mol·L-1NaOH溶液,再加入2滴镁试剂(1)染料(对硝基苯偶氮苯二酚)。若出现沉淀并吸附镁试剂(I)染料呈天蓝色,表示待测液中含有Mg2+。(注:Ag+、Cu2+、Fe3+、NH4+会妨碍Mg2+的检测)
(2)Mg(OH)2可溶于浓的氯化铵溶液,其他的常见不溶性碱难溶于氯化铵溶液。
【实验探究】
(1)甲同学进行了初步实验,实验步骤和实验现象如下,请填写下表:
(2)乙同学取甲同学第②组实验所得的溶液,加入2滴NaOH溶液及镁试剂(Ⅰ)染料,未见天蓝色物质。他得出合金中不含镁的结论,乙同学的结论 (选填“正确”或“错误”),你的理由是 。
(3)丙同学设计实验方案,确定焰火原料中的金属种类,实验记录如下
由丙同学的实验记录可知该焰火原料是由 和 两种金属组成的合金;
实验中滤液加入足量氢氧化钠溶液后需煮沸的理由 。
查看习题详情和答案>>