网址:http://m.1010jiajiao.com/timu3_id_273651[举报]
(14分)(1)化学平衡常数K表示可逆反应的进行程度,K值越大,表示可逆反应进行得越完全,K值大小与温度的关系是:温度升高,K值_______________(填“一定增大”“一定减小”或“可能增大也可能减小”)。
(2)在一体积为10L的容器中,通入一定量的CO和H2O,在800℃时发生如下反应:
CO(g)+H2O (g) ![]() CO2(g)+H2 (g) △H<0
CO2(g)+H2 (g) △H<0
CO和H2O物质的量浓度变化如下图(a)所示,则:
① 0-4min间平均反应速率v(CO)=________ mol??L-1??min-1
②在800℃时该反应的化学平衡常数K=___________________________(要求写出表达式及数值);CO的转化率=______________。
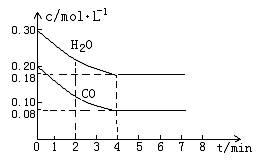
图(a)
③在800℃时,若反应开始时此容器中CO和H2O的浓度分别为0.20 mol/L和0.80 mol/L,则达到平衡时CO转化为CO2的转化率是:______________________。
(3)25℃时,Ksp[Mg(OH)2]=5.61×10-12,Ksp[MgF2]=7.42×10-11。下列说法正确的是_______
A.25℃时,饱和Mg(OH)2溶液与饱和MgF2溶液相比, c(Mg2+)后者大
B.25℃时,在Mg(OH)2的悬浊液中加入少量的NH4Cl固体,c(Mg2+)减小
C.25℃时,Mg(OH)2固体在20mL0.01mol·L-1氨水中的Ksp和在20mL0.01 mol·L-1
NH4Cl溶液中的Ksp相等
D.25℃时,在Mg(OH)2悬浊液中加入NaF溶液后,Mg(OH)2可能转化为MgF2
E.25℃ 时,某饱和Mg(OH)2溶液中c(Mg2+)=0.0561mol·L-1,则溶液的pH=9
(4)根据化学反应速率与化学平衡理论,联系化工生产实际,你认为下列说法不正确的是 。
A.化学反应速率理论可指导怎样在一定时间内快出产品
B.有效碰撞理论可指导怎样提高原料的转化率
C.勒夏特列原理可指导怎样使用有限原料多出产品
D.催化剂的使用是提高产品率的有效方法
E.正确利用化学反应速率和化学反应限度都可以提高化工生产的综合经济效益
查看习题详情和答案>>(1)6.0g液态偏二甲肼与足量的液态四氧化二化氮完全反应生成N2(g)、CO2(g)、H2O(g)、放出225.0kJ的热量.
①写出上述反应的热化学方程式:
②下列判断正确的是
A、物质的燃烧反应必须有氧气参加
B、该反应中氧化剂与还原剂物质的量之比为2:1
C、偏二甲肼燃烧热为2250kJ/mol
D、偏二甲肼与四氧化二氮作火箭推进剂是二者发生剧烈的氧化还原反放出大量的热和产生大量气体的原因
(2)使用偏二甲肼与四氧化二氮作燃料,使发射场产生棕黄色“蘑菇”云弥漫,损害工作人员的身体健康,带来一些后遗症.产生棕黄色“蘑菇”云的可能原因
(3)新的环保低温燃料计划在2014年到2016年使用,将在海南发射场发射中等推力火箭的时候采用,新的低温燃料是液氢.利用核能把水分解,制取氢气,是目前许多国家正在研究的课题.下图是国外正在研究的一种流程(硫-碘热循环法),其中用了过量的碘.
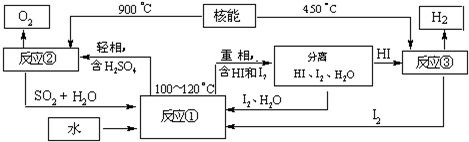
写出①反应的化学方程式
用硫-碘热循环法制取氢最大的优点是
(1)A为0.1mol/L的(NH4)2SO4溶液,在该溶液中各种离子的浓度由大到小顺序为
(2)B为0.1mol/L NaHCO3溶液,请分析NaHCO3溶液显碱性的原因:
- 3 |
- 3 |
(3)C为FeCl3溶液,实验室中配制FeCl3溶液时常加入
- 3 |
- 3 |
(4)D为含有足量AgCl固体的饱和溶液,AgCl在水中存在沉淀溶解平衡:AgCl(s)?Ag+(aq)+Cl-(aq),在25℃时,氯化银的Ksp=1.8×10-10.现将足量氯化银分别放入:
①100mL蒸馏水中;②100mL 0.2mol/L AgNO3溶液中;③100mL 0.1mol/L氯化铝溶液中;④100mL 0.1mol/L盐酸中,充分搅拌后,相同温度下c(Ag+)由大到小的顺序是
(5)E为CuSO4溶液,已知25℃时,Ksp[Cu(OH)2]=2×10-20.要使0.2mol?L-1 E溶液中Cu2+沉淀较为完全(使Cu2+浓度降至原来的千分之一),则应向溶液里加入NaOH溶液,使溶液的pH为