摘要:配制600ml溶质质量分数为20%的稀硫酸需98%的浓硫酸和蒸馏水各多少毫升?(硫酸的密度和硫酸溶液中溶质质量分数对照表) 密度(g/cm3) 1.07 1.14 1.22 1.30 1.40 1.50 1.61 1.73 1.81 1.84 质量分数(%) 10 20 30 40 50 60 70 80 90 98
网址:http://m.1010jiajiao.com/timu3_id_2731[举报]
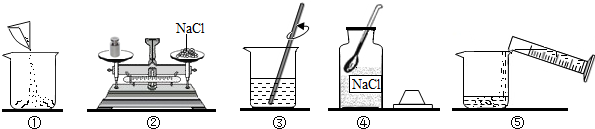
如图是小强配制100g溶质质量分数为12%的NaCl溶液的实验操作示意图: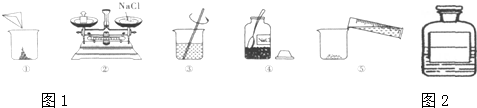
(1)图1中的玻璃仪器分别是广口瓶、量筒、烧杯和
(2)指出图1中的一处错误操作
(3)配制时应选择
(4)请在装有所配制溶液的试剂瓶(见图)标签上标明主要相应信息;
(5)若所配溶液的质量分数偏低,其原因可能是
查看习题详情和答案>>

(1)图1中的玻璃仪器分别是广口瓶、量筒、烧杯和
玻璃棒
玻璃棒
;(2)指出图1中的一处错误操作
操作②中氯化钠与砝码的位置颠倒了
操作②中氯化钠与砝码的位置颠倒了
;(3)配制时应选择
100
100
mL(选填“10mL”“50mL“或“100mL”)的量筒量取所需要的水;(4)请在装有所配制溶液的试剂瓶(见图)标签上标明主要相应信息;
(5)若所配溶液的质量分数偏低,其原因可能是
量液体水时仰视液面读数(合理即可)
量液体水时仰视液面读数(合理即可)
.20、下图是小明配制100g溶质质量分数12%的氯化钠溶液的有关实验操作示意图.
(1)配制过程中使用的四种玻璃仪器,分别是广口瓶、
(2)请你指出图中一处错误操作,并分析该操作可能造成的后果.
(3)图②、图③表示的操作步骤分别是
(4)配制时需称量氯化钠
(5)在量取蒸馏水体积时,若仰视读数,则会导致氯化钠溶液的溶质质量分数
查看习题详情和答案>>

(1)配制过程中使用的四种玻璃仪器,分别是广口瓶、
烧杯
、玻璃棒
、量筒.(2)请你指出图中一处错误操作,并分析该操作可能造成的后果.
②
,溶质质量偏小,质量分数偏小
.(3)图②、图③表示的操作步骤分别是
称量
、溶解
.(4)配制时需称量氯化钠
12
g,如果氯化钠中含有少量不溶的杂质,溶质的质量分数会偏小
(填“偏大”或“偏小”);量取水最好选择③
的量筒(填序号①10mL ②50mL ③100mL).(水的密度为1g/cm3)(5)在量取蒸馏水体积时,若仰视读数,则会导致氯化钠溶液的溶质质量分数
<
(填“<”或“>”)12%.
实验室提供:①天平 ②量筒 ③烧杯 ④药匙 ⑤玻璃棒
(1)小茜同学用固体氯化钠配制 50g 溶质质量分数为10% 的氯化钠溶液.
①需固体氯化钠 g,水 mL.
②用天平称量时,若指针偏右,应进行的操作是 .
③下列操作会导致溶液中溶质的质量分数<10% 的是 (填字母).
a、称量时砝码和氯化钠的位置颠倒 b、往烧杯中倒入氯化钠有少量氯化钠洒落
c、往烧杯中倒入水有少量水洒落 d、用量筒取蒸馏水时,仰视凹液面最低处读数
(2)小强同学用密度为 1.84g/cm3溶质质量分数为98% 的浓硫酸与水配制 90g 溶质质量分数为20% 的稀硫酸.
①需浓硫酸 mL.(保留整数)
②其操作要领是 a.
③小强同学不慎将浓硫酸沾到了手上,他应立即进行的操作是 .
(3)小茜和小强同学的实验中都用到了玻璃棒,其作用分别是: 、 .
查看习题详情和答案>>
(1)小茜同学用固体氯化钠配制 50g 溶质质量分数为10% 的氯化钠溶液.
①需固体氯化钠
②用天平称量时,若指针偏右,应进行的操作是
③下列操作会导致溶液中溶质的质量分数<10% 的是
a、称量时砝码和氯化钠的位置颠倒 b、往烧杯中倒入氯化钠有少量氯化钠洒落
c、往烧杯中倒入水有少量水洒落 d、用量筒取蒸馏水时,仰视凹液面最低处读数
(2)小强同学用密度为 1.84g/cm3溶质质量分数为98% 的浓硫酸与水配制 90g 溶质质量分数为20% 的稀硫酸.
①需浓硫酸
②其操作要领是
③小强同学不慎将浓硫酸沾到了手上,他应立即进行的操作是
(3)小茜和小强同学的实验中都用到了玻璃棒,其作用分别是: