网址:http://m.1010jiajiao.com/timu3_id_270019[举报]
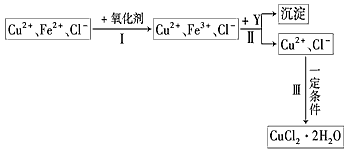
(1)步骤Ⅰ中,将Fe2+转化为Fe3+最好选用下列氧化剂中的________(填字母).
A.K2Cr2O7 B.NaClO C.H2O2
该反应的离子方程式为____________________。
(2)在步骤Ⅱ中,加入Y的目的是为了调节溶液的酸度以促使Fe3+沉淀完全,Y可以是下列物质中的
________(填字母)。
A.NaOH B.Cu C.Cu2(OH)2CO3
(3)步骤Ⅲ应控制的实验条件是________________________。
CuCl2溶液中含有少量杂质FeCl2,为制备纯净的CuCl2·2H2O晶体,拟定实验步骤如下图所示:
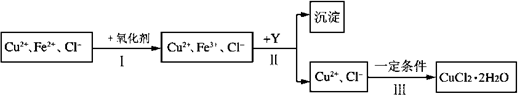
请回答下列问题:
(1)步骤Ⅰ中,将Fe2+转化为Fe3+最好选用下列氧化剂中的________(填字母).
A.K2Cr2O7 B.NaClO C.H2O2
该反应的离子方程式为________.
(2)在步骤Ⅱ中,①加入Y的目的是为了调节溶液的酸度以促使Fe3+沉淀完全,Y可以是下列物质中的________(填字母);
A.NaOH B.Cu C.Cu2(OH)2CO3
②江河入海口处易形成沙洲的原因是江水中的胶粒遇海水中的电解质发生凝聚.将步骤Ⅱ中沉淀制成胶体后,再逐滴加入稀硫酸可能看到的现象是________.
(3)步骤Ⅲ应控制的实验条件是________.
CuCl2溶液中含有少量杂质FeCl2,为制备纯净的CuCl2·2H2O晶体,拟定实验步骤如下图所示:
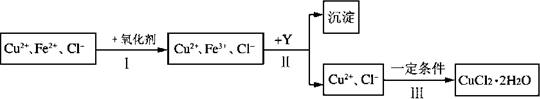
请回答下列问题:
(1)步骤Ⅰ中,将Fe2+转化为Fe3+最好选用下列氧化剂中的________(填字母).
A.K2Cr2O7 B.NaClO C.H2O2
该反应的离子方程式为________.
(2)在步骤Ⅱ中,①加入Y的目的是为了调节溶液的酸度以促使Fe3+沉淀完全,Y可以是下列物质中的________(填字母);
A.NaOH B.Cu C.Cu2(OH)2CO3
②江河入海口处易形成沙洲的原因是江水中的胶粒遇海水中的电解质发生凝聚.将步骤Ⅱ中沉淀制成胶体后,再逐滴加入稀硫酸可能看到的现象是________.
(3)步骤Ⅲ应控制的实验条件是________.
CuCl2溶液中含有少量杂质FeCl2,为制备纯净的CuCl2·2H2O晶体,拟定实验步骤如下图所示:

请回答下列问题:
(1)步骤Ⅰ中,将Fe2+转化为Fe3+最好选用下列氧化剂中的________(填字母).
A.K2Cr2O7 B.NaClO C.H2O2
该反应的离子方程式为________.
(2)在步骤Ⅱ中,①加入Y的目的是为了调节溶液的酸度以促使Fe3+沉淀完全,Y可以是下列物质中的________(填字母);
A.NaOH B.Cu C.Cu2(OH)2CO3
②江河入海口处易形成沙洲的原因是江水中的胶粒遇海水中的电解质发生凝聚.将步骤Ⅱ中沉淀制成胶体后,再逐滴加入稀硫酸可能看到的现象是________.
(3)步骤Ⅲ应控制的实验条件是________.
(15分)某厂用含有少量杂质FeCl2的CuCl2溶液制备纯净的CuCl2·2H2O晶体, 为降低成本且不造成空气污染,拟定实验步骤如下: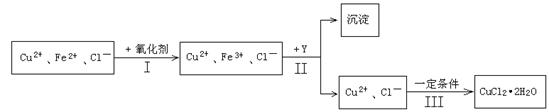
一些金属氢氧化物沉淀的PH
| 金属离子 | PH | |
| 开始沉淀 | 沉淀完全 | |
| Fe2+ | 7.6 | 9.6 |
| Fe3+ | 2.7 | 3.7 |
| Cu2+ | 4.4 | 4.6 |
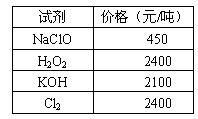
回答下列问题:
(1)步骤Ⅰ中,将Fe2+转化为Fe3+最好选用下列氧化剂中的________(填字母)。
A.H2O2 B.NaClO C.KOH D.Cl2
该反应的离子方程式为____________________________________________。
(2)在步骤Ⅱ中,①加入Y的目的是为了调节溶液的酸度以促使Fe3+沉淀完全,Y可以选用下列物质中的________________(填字母);
A.NaOH B.CuO C.Cu(OH)2 D.Cu2(OH)2CO3
②江河入海口处易形成沙洲的原因是江水中的胶粒遇海水中的电解质发生聚沉。将步骤Ⅱ中沉淀经过适当步骤制成胶体后,再逐滴加入稀硫酸可能看到的现象是_________。
(3)步骤Ⅲ应控制的实验条件是 ________________________ 。 查看习题详情和答案>>