摘要:关于“永动机 的下列说法中正确的是 ( ) A.不消耗任何能量.却能源源不断地对外做功的机器是绝对不能制造成功的.因为它违背了能的转化和守恒定律 B.只要不违背能的转化和守恒定律的机器总是能够制造成功的 C.只从单一热源取热.使之完全变为有用功而不产生其他影响的机器是可以制造出来的 D.热效率是百分之百的热机是绝对不可能制造出来的
网址:http://m.1010jiajiao.com/timu3_id_269748[举报]
 (2013?浦东新区三模)如图为某有机物的结构简式.已知酯类在铜铬氧化物(CuO?CuCrO4)催化下,与氢气反应得到醇,羰基双键可同时被还原,但苯环在催化氢化过程中不变,其反应原理如下:RCOOR′+2H2
(2013?浦东新区三模)如图为某有机物的结构简式.已知酯类在铜铬氧化物(CuO?CuCrO4)催化下,与氢气反应得到醇,羰基双键可同时被还原,但苯环在催化氢化过程中不变,其反应原理如下:RCOOR′+2H2| 铜铬氧化物 |
查看习题详情和答案>>
温室效应和资源短缺等问题和如何降低大气中的CO2含量并加以开发利用引起了各国的普遍重视.目前工业上有一种方法是用CO2生产燃料甲醇.一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),如图1表示该反应进行过程中能量(单位为kJ?mol-1)的变化.
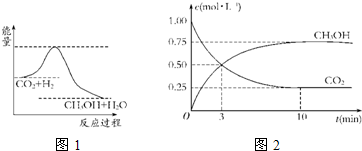
(1)关于该反应的下列说法中,正确的是
A.△H>0,△S>0
B.△H>0,△S<0
C.△H<0,△S<0
D.△H<0,△S>0
(2)该反应平衡常数K的表达式为
.
(3)温度降低,平衡常数K
(4)为探究反应原理,现进行如下实验:在体积为1L的密闭容器中,充入1mol CO2和3mol H2,测得CO2和CH3OH(g)的浓度随时间变化如图2所示.从反应开始到平衡,用氢气浓度变化表示的平均反应速率v(H2)
(5)下列措施中能使n(CH3OH)/n(CO2)增大的有
A.升高温度
B.加入催化剂
C.将H2O(g)从体系中分离
D.再充入1mol CO2和3mol H2
E.充入He(g),使体系总压强增大.
查看习题详情和答案>>

(1)关于该反应的下列说法中,正确的是
C
C
.A.△H>0,△S>0
B.△H>0,△S<0
C.△H<0,△S<0
D.△H<0,△S>0
(2)该反应平衡常数K的表达式为
| c(CH3OH)?c(H2O) |
| c(CO2)?c3(H2) |
| c(CH3OH)?c(H2O) |
| c(CO2)?c3(H2) |
(3)温度降低,平衡常数K
增大
增大
(填“增大”、“不变”或“减小”).(4)为探究反应原理,现进行如下实验:在体积为1L的密闭容器中,充入1mol CO2和3mol H2,测得CO2和CH3OH(g)的浓度随时间变化如图2所示.从反应开始到平衡,用氢气浓度变化表示的平均反应速率v(H2)
0.225
0.225
mol?L-1?min-1.(5)下列措施中能使n(CH3OH)/n(CO2)增大的有
CD
CD
.A.升高温度
B.加入催化剂
C.将H2O(g)从体系中分离
D.再充入1mol CO2和3mol H2
E.充入He(g),使体系总压强增大.
由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引起了各国的普遍重视.目前工业上有一种方法是用CO2生产燃料甲醇.一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),如图1表示该反应进行过程中能量(单位为kJ?mol-1)的变化.
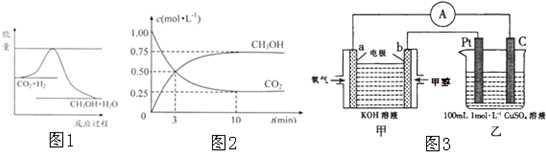
(1)关于该反应的下列说法中,正确的是
A.△H>0,△S>0; B.△H>0,△S<0;
C.△H<0,△S<0; D.△H<0,△S>0.
(2)该反应平衡常数K的表达式为
.
(3)温度降低,平衡常数K
(4)为探究反应原理,现进行如下实验:在体积为1L的恒容密闭容器中,充入1molCO2和3molH2,测得CO2和CH3OH(g)的浓度随时问变化如图2所示.从反应开始到平衡,用氢气浓度变化表示的平均反应速率v(H2):
(5)下列措施中能使(4)中n(CH3OH)/n(CO2)增大的有
A.升高温度;
B.加入催化剂;
C.将H2O(g)从体系中分离;
D.再充入1molCO2和3molH2;
E.充入He(g),使体系总压强增大.
(6)生成的甲醇可设计为燃料电池,如图3现有甲装置为原电池,乙装置为电解池.
①b电极上发生的电极反应式为:
②若甲中有0.1mol CH3OH参加反应,则乙装置中生成的气体在标准状况下的体积共为
查看习题详情和答案>>

(1)关于该反应的下列说法中,正确的是
C
C
.A.△H>0,△S>0; B.△H>0,△S<0;
C.△H<0,△S<0; D.△H<0,△S>0.
(2)该反应平衡常数K的表达式为
| c(CH3OH).c(H2O) |
| c(CO2).c3(H2) |
| c(CH3OH).c(H2O) |
| c(CO2).c3(H2) |
(3)温度降低,平衡常数K
增大
增大
(填“增大”、“不变”或“减小”).(4)为探究反应原理,现进行如下实验:在体积为1L的恒容密闭容器中,充入1molCO2和3molH2,测得CO2和CH3OH(g)的浓度随时问变化如图2所示.从反应开始到平衡,用氢气浓度变化表示的平均反应速率v(H2):
0.225
0.225
mol?L-1?min-1.(5)下列措施中能使(4)中n(CH3OH)/n(CO2)增大的有
CD
CD
.A.升高温度;
B.加入催化剂;
C.将H2O(g)从体系中分离;
D.再充入1molCO2和3molH2;
E.充入He(g),使体系总压强增大.
(6)生成的甲醇可设计为燃料电池,如图3现有甲装置为原电池,乙装置为电解池.
①b电极上发生的电极反应式为:
CH3OH-6e-+8OH-=CO32-+6H2O
CH3OH-6e-+8OH-=CO32-+6H2O
.②若甲中有0.1mol CH3OH参加反应,则乙装置中生成的气体在标准状况下的体积共为
7.84
7.84
L.