摘要:在10℃和2´105pa的条件下.反应aA(g) dD(g)+eE(g)建立平衡后.再逐步增大体系的压强.下表列出了不同压强下反应建立平衡时物质D的浓度. 压强/pa 2´105 5´105 1´106 D的浓度/mol·L-1 0.085 0.20 0.44 根据表中数据.回答下列问题: ⑴压强以2´105pa增加到5´105pa时.平衡向 反应方向移动.理由是 ⑵压强从5´105pa增加到1´106pa时.平衡向 反应方向移动.理由是 .平衡之所以向该方向移动.可能的原因是
网址:http://m.1010jiajiao.com/timu3_id_269523[举报]
ⅥA族的氧、硫、硒(Se)、碲(Te)等元素在化合物中常表现出多种氧化态,含ⅥA族元素的化合物在研究和生产中有许多重要用途.请回答下列问题:
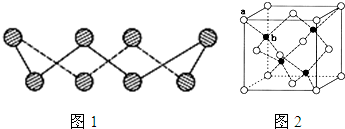
(1)S单质的常见形式是S8,其环状结构如图1所示,S原子采用的轨道杂化方式是
(2)原子的第一电离能是指气态电中性基态原子失去一个电子转化为气态基态正离子所需要的最低能量,O、S、Se原子的第一电离能由大到小的顺序为
(3)Se的原子序数为
(4)H2Se的酸性比 H2S
离子的立体构型为
(5)H2SeO3 的K1和K2分别是2.7×10-3和2.5×10-8,H2SeO4的第一步几乎完全电离,K2是1.2×10-2,请根据结构与性质的关系解释:
①H2SeO3和H2SeO4的第一步电离程度大于第二步电离的原因:
②H2SeO4比H2SeO3酸性强的原因:
(6)ZnS在荧光体、光导体材料、涂料、颜料等行业中应用广泛.立方ZnS晶体结构如图2所示,其晶胞边长为540.0pm,密度为
=4.1
=4.1g?cm-3(列式并计算),a位置S2-离子与b位置Zn2+离子之间的距离为
或
或135
或
或135
pm(列式表示)
查看习题详情和答案>>

(1)S单质的常见形式是S8,其环状结构如图1所示,S原子采用的轨道杂化方式是
sp3
sp3
;(2)原子的第一电离能是指气态电中性基态原子失去一个电子转化为气态基态正离子所需要的最低能量,O、S、Se原子的第一电离能由大到小的顺序为
O>S>Se
O>S>Se
;(3)Se的原子序数为
34
34
,其核外M层电子的排布式为3s23p63d10
3s23p63d10
;(4)H2Se的酸性比 H2S
强
强
(填“强”或“弱”).气态SeO3分子的立体构型为平面三角形
平面三角形
,| SO | 2- 3 |
三角锥形
三角锥形
;(5)H2SeO3 的K1和K2分别是2.7×10-3和2.5×10-8,H2SeO4的第一步几乎完全电离,K2是1.2×10-2,请根据结构与性质的关系解释:
①H2SeO3和H2SeO4的第一步电离程度大于第二步电离的原因:
第一步电离后生成的负离子较难再进一步电离出带正电荷的氢离子
第一步电离后生成的负离子较难再进一步电离出带正电荷的氢离子
;②H2SeO4比H2SeO3酸性强的原因:
H2SeO3和H2SeO4可表示为(HO)SeO和(HO)SeO2.H2SeO3中Se为+4价,而H2SeO4中Se为+6价,正电性更高.导致Se-O-H中的O原子更向Se偏移,越易电离出H+
H2SeO3和H2SeO4可表示为(HO)SeO和(HO)SeO2.H2SeO3中Se为+4价,而H2SeO4中Se为+6价,正电性更高.导致Se-O-H中的O原子更向Se偏移,越易电离出H+
.(6)ZnS在荧光体、光导体材料、涂料、颜料等行业中应用广泛.立方ZnS晶体结构如图2所示,其晶胞边长为540.0pm,密度为
| ||
| (540.0×10-10cm)3 |
| ||
| (540.0×10-10cm)3 |
| 270.0 | ||
|
135.0×
| ||
sin
|
| 3 |
| 270.0 | ||
|
135.0×
| ||
sin
|
| 3 |
某化学课外兴趣小组探究铜与浓硫酸的反应情况.甲.乙.丙三位同学进行了下列实验:取12.8g铜片和20ml.18mol/L的浓硫酸放在圆底烧瓶中共热,直至反应完毕,最后发现烧瓶中还有铜片剩余外,同时根据所学的知识认为还有较多的硫酸剩余.
(1)请写出铜跟浓硫酸反应的化学方程式:
可以证明有余酸的实验方案是
(a)再加入铁粉(b)再滴入BaCl2溶液(c)再加入银(d)再滴入Na2CO3溶液
(2)甲学生设计求余酸浓度的实验方案是测定产生气体的量.其方法有多种,请问下列方案中不可行的是
(a)将产生的气体缓缓通过预先称量盛有碱石灰的干燥管,结束反应后再次称量.
(b)将产生的气体缓缓通入酸性高锰酸钾溶液,再加入足量BaCl2溶液,过滤、洗涤、干燥、称量沉淀.
(c)用排水法测定其产生气体的体积(折算成标准状况).
(d)用排饱和NaHSO3溶液的方法测出其产生气体的体积(折算成标准状况).
(3)乙同学设计测定余酸浓度的实验方案是:测定反应后的混合液中Cu2+的量.在反应后的溶液中加蒸馏水稀释至100ml,加入足量Na2S溶液,充分反应后,过滤.洗涤.干燥、称量沉淀.请写出生成沉淀的离子方程式:
(4)根据甲、乙两同学的实验方案,除测算产生气体的物质的量或反应掉的铜的物质的量外,尚缺少的测量数据是
(5)丙同学提出甲、乙两同学的实验方案设计的复杂,为此他设计了下列较为简易的实验方案:取出反应后的铜片,进行洗涤.干燥.称量.若称得剩余铜片的质量为Wg,测得反应后溶液的体积为Vml,请计算剩余硫酸的物质的量浓度=
mol/L(用含W.V的代数式表示)
查看习题详情和答案>>
(1)请写出铜跟浓硫酸反应的化学方程式:
Cu+2H2SO4(浓)
CuSO4+2H2O+SO2↑
| ||
Cu+2H2SO4(浓)
CuSO4+2H2O+SO2↑
,试问:为什么较多的余酸不再与铜片继续反应?简述理由:
| ||
铜片过量,硫酸反应后溶液变稀不支持反应
铜片过量,硫酸反应后溶液变稀不支持反应
.可以证明有余酸的实验方案是
ad
ad
(填写字母,错选或多选扣分)(a)再加入铁粉(b)再滴入BaCl2溶液(c)再加入银(d)再滴入Na2CO3溶液
(2)甲学生设计求余酸浓度的实验方案是测定产生气体的量.其方法有多种,请问下列方案中不可行的是
ac
ac
(填写字母,错选或多选扣分)(a)将产生的气体缓缓通过预先称量盛有碱石灰的干燥管,结束反应后再次称量.
(b)将产生的气体缓缓通入酸性高锰酸钾溶液,再加入足量BaCl2溶液,过滤、洗涤、干燥、称量沉淀.
(c)用排水法测定其产生气体的体积(折算成标准状况).
(d)用排饱和NaHSO3溶液的方法测出其产生气体的体积(折算成标准状况).
(3)乙同学设计测定余酸浓度的实验方案是:测定反应后的混合液中Cu2+的量.在反应后的溶液中加蒸馏水稀释至100ml,加入足量Na2S溶液,充分反应后,过滤.洗涤.干燥、称量沉淀.请写出生成沉淀的离子方程式:
Cu2++S2-═CuS↓
Cu2++S2-═CuS↓
.(4)根据甲、乙两同学的实验方案,除测算产生气体的物质的量或反应掉的铜的物质的量外,尚缺少的测量数据是
反应后溶液的体积
反应后溶液的体积
.(5)丙同学提出甲、乙两同学的实验方案设计的复杂,为此他设计了下列较为简易的实验方案:取出反应后的铜片,进行洗涤.干燥.称量.若称得剩余铜片的质量为Wg,测得反应后溶液的体积为Vml,请计算剩余硫酸的物质的量浓度=
| 0.36-(12.8-w)/32 |
| V×1×10 -3 |
| 0.36-(12.8-w)/32 |
| V×1×10 -3 |
判断正误,正确的划“√”,错误的划“×”
(1)天然气和沼气的主要成分是甲烷
(2)煤可与水蒸气反应制成水煤气,水煤气的主要成分是CO和H2
(3)干馏煤可以得到甲烷、苯和氨等重要化工原料
(4)石油分馏可获得乙酸、苯及其衍生物
(5)石油和天然气的主要成分都是碳氢化合物
(6)煤的干馏和石油的分馏均属化学变化
(7)煤油可由石油分馏获得,可用作燃料和保存少量金属钠
(8)甲烷、乙烯和苯在工业上都可通过石油分馏得到
(9)用溴水鉴别苯和正己烷
(10)石油是混合物,其分馏产品汽油为纯净物
(11)石油催化裂化的主要目的是提高汽油等轻质油的产量与质量;石油裂解的主要目的是得到更多的乙烯、丙烯等气态短链烃
(12)煤气的主要成分是丁烷 .
查看习题详情和答案>>
(1)天然气和沼气的主要成分是甲烷
(2)煤可与水蒸气反应制成水煤气,水煤气的主要成分是CO和H2
(3)干馏煤可以得到甲烷、苯和氨等重要化工原料
(4)石油分馏可获得乙酸、苯及其衍生物
(5)石油和天然气的主要成分都是碳氢化合物
(6)煤的干馏和石油的分馏均属化学变化
(7)煤油可由石油分馏获得,可用作燃料和保存少量金属钠
(8)甲烷、乙烯和苯在工业上都可通过石油分馏得到
(9)用溴水鉴别苯和正己烷
(10)石油是混合物,其分馏产品汽油为纯净物
(11)石油催化裂化的主要目的是提高汽油等轻质油的产量与质量;石油裂解的主要目的是得到更多的乙烯、丙烯等气态短链烃
(12)煤气的主要成分是丁烷
氨在国民经济中占有重要的地位,2008年,我国氨产量接近500万吨.下图是合成氨的简要流程.

(1)下表是空气中部分气体的沸点.将空气液化加热分馏,依据下表数据判断,最先气化得到的气体是
(2)天然气、重油、煤都可以与水反应制得氢气.下表是某合成氨厂采用不同原料的相对投资和能量消耗.
①依据上表信息,你认为采用
②请写出甲烷在高温、催化剂的作用下与水蒸气反应生成氢气和一氧化碳的化学方程式:
③已知C(s)、CO(g)和H2(g)完全燃烧的热化学方程式分别为:
C(s)+O2(g)═CO2(g)△H=-394kJ?mol-1;
2CO(g)+O2(g)═2CO2(g)△H=-566kJ?mol-1;
2H2(g)+O2(g)═2H2O(g)△H=-484kJ?mol-1;
试写出由C于水蒸气在高温条件下反应生成氢气与一氧化碳的热化学方程式
(3)下表是在某种催化剂作用下用体积比为1:3的氮、氢混合气反应应达到平衡时的一些实验数据.
①依据表中数据判断,合成氨反应N2+3H2 2NH3的△H
2NH3的△H
②该反应的化学平衡常数表达式为
.
③在300℃、10MPa下,合成氨反应达到平衡时,混合气体的体积是反应开始时的
查看习题详情和答案>>

(1)下表是空气中部分气体的沸点.将空气液化加热分馏,依据下表数据判断,最先气化得到的气体是
氦气
氦气
.| 气体名称 | 氨气 | 氧气 | 氦气 | 氖气 | 氩气 | 氪气 | 氚气 |
| 沸点/℃ | -196 | -183 | -269 | -264 | -186 | -153 | -108 |
| 原料 | 天然气 | 重油 | 煤 |
| 相对投资费用 | 1.0 | 1.5 | 2.0 |
| 能量消耗/J?t-1 | 28×109 | 38×109 | 48×109 |
天然气
天然气
为原料最好.②请写出甲烷在高温、催化剂的作用下与水蒸气反应生成氢气和一氧化碳的化学方程式:
CH4+H2O
CO+3H2
| ||
| 高温 |
CH4+H2O
CO+3H2
.
| ||
| 高温 |
③已知C(s)、CO(g)和H2(g)完全燃烧的热化学方程式分别为:
C(s)+O2(g)═CO2(g)△H=-394kJ?mol-1;
2CO(g)+O2(g)═2CO2(g)△H=-566kJ?mol-1;
2H2(g)+O2(g)═2H2O(g)△H=-484kJ?mol-1;
试写出由C于水蒸气在高温条件下反应生成氢气与一氧化碳的热化学方程式
C(s)+H2O(g)=CO(g)+H2(g)△H=+131kJ?mol-1
C(s)+H2O(g)=CO(g)+H2(g)△H=+131kJ?mol-1
.(3)下表是在某种催化剂作用下用体积比为1:3的氮、氢混合气反应应达到平衡时的一些实验数据.
| NH3含量% 压强/MPa 温度/℃ |
0.1 | 10 | 20 | 30 | 60 | 100 |
| 200 | 15.3 | 81.5 | 86.4 | 89.9 | 95.4 | 98.8 |
| 300 | 2.2 | 52.0 | 64.2 | 71.0 | 84.2 | 92.6 |
| 400 | 0.4 | 25.1 | 38.2 | 47.0 | 65.2 | 79.8 |
| 500 | 0.1 | 10.6 | 19.1 | 26.4 | 42.2 | 57.5 |
| 600 | 0.05 | 4.5 | 9.1 | 13.8 | 23.1 | 31.4 |
 2NH3的△H
2NH3的△H<
<
(填“>”、“<”或“无法判断”)0,请简要说明理由相同条件下,升高温度,NH3含量减小,平衡左移,逆反应吸热,正反应放热
相同条件下,升高温度,NH3含量减小,平衡左移,逆反应吸热,正反应放热
;②该反应的化学平衡常数表达式为
| c2(NH3) |
| c(N2)?c3(H2) |
| c2(NH3) |
| c(N2)?c3(H2) |
③在300℃、10MPa下,合成氨反应达到平衡时,混合气体的体积是反应开始时的
0.66
0.66
倍.甲同学釆用如图Ⅰ所示装置验证铜与稀硝酸的反应,并用排水法收集NO气体
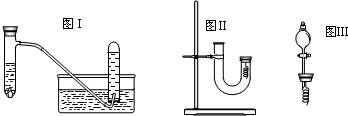
(1)写出试管内溶液中发生反应的化学方程式
(2)在实验过程中观察到试管内的溶液呈
(3)乙同学认为甲虽然收集到的气体是一氧化氮,但并不能说明反应中一定生成一氧化氮.他的理由是
有关化学方程式为:
(4)丙同学釆用如图Ⅱ所示装置进行实验,证明了铜与稀硝酸反应生成一氧化氮.该同学的步骤如下表所示,请回答实验中的有关问题.
(5)从环保的角度看,丙同学的实验存在的缺陷是
(6)丁同学用图Ⅲ所示装置代替图Ⅱ中U型管右端的附有铜丝的胶塞进行实验,待反应停止后将一氧化氮气体排入分液漏斗中,观察到的实验现象与丙同学实验的第
(7)实验结束后丁同学向分液漏斗中注入适量水并充分振荡,试写出发生的化学反应方程式
(8)若将32.64g铜与140mL一定浓度的硝酸反应,铜完全溶解,产生的NO和NO2混合气体在标准状况下的体积为11.2L(不考虑NO2的反应),试回答:
①若铜与硝刚好反应完全,则原硝酸溶液的物质的量浓度为
②将产生的气体全部释放后,向溶液中加入VmL amol?L-1的NaOH溶液,恰好使溶液中的Cu2+全部转化为沉淀,则原硝酸溶液的物质的量浓度为
mol/L
mol/L
③已知NO和NO2的混合气与足量氧气混合后能被水完全吸收成硝酸,则要使上述11.2L气体完全被水吸收成硝酸,理论上需消耗标准状况下的氧气
查看习题详情和答案>>

(1)写出试管内溶液中发生反应的化学方程式
3Cu+8HNO3=3Cu(NO3 ) 2+2NO↑+4H2O
3Cu+8HNO3=3Cu(NO3 ) 2+2NO↑+4H2O
(2)在实验过程中观察到试管内的溶液呈
绿
绿
色;收集气体的试管内的气体呈无
无
色(3)乙同学认为甲虽然收集到的气体是一氧化氮,但并不能说明反应中一定生成一氧化氮.他的理由是
在铜和稀硝酸反应容器的上部看到了红棕色气体
在铜和稀硝酸反应容器的上部看到了红棕色气体
在铜和稀硝酸反应容器的上部看到了红棕色气体
在铜和稀硝酸反应容器的上部看到了红棕色气体
有关化学方程式为:
2NO+O2=2NO2
2NO+O2=2NO2
(4)丙同学釆用如图Ⅱ所示装置进行实验,证明了铜与稀硝酸反应生成一氧化氮.该同学的步骤如下表所示,请回答实验中的有关问题.
| 实验步骤 | 问题 |
| 1从U型管左端加入稀硝酸直至充满U型管右端 | ∥/ |
| 2用附有铜丝的胶塞塞住U型管右端,观察现象 | 现象是 有无色气体产生,右边溶液逐渐变成绿色 有无色气体产生,右边溶液逐渐变成绿色 |
| 3待反应停止后打开胶塞,观察实验现象 | 现象是 无色气体与空气接触后立即变成红棕色 无色气体与空气接触后立即变成红棕色 |
将氮氧化合物放入空气中会污染环境
将氮氧化合物放入空气中会污染环境
.(6)丁同学用图Ⅲ所示装置代替图Ⅱ中U型管右端的附有铜丝的胶塞进行实验,待反应停止后将一氧化氮气体排入分液漏斗中,观察到的实验现象与丙同学实验的第
3
3
步骤的相同.丁同学要将一氧化氮气体排入分液漏斗中应进行的正确操作是①打开分液漏斗上部的塞子
打开分液漏斗上部的塞子
②慢慢打开分液漏斗的活塞
慢慢打开分液漏斗的活塞
③待液面与胶塞接触时立即关闭活塞
待液面与胶塞接触时立即关闭活塞
(7)实验结束后丁同学向分液漏斗中注入适量水并充分振荡,试写出发生的化学反应方程式
3NO2+H2O=2 HNO3+NO
3NO2+H2O=2 HNO3+NO
(8)若将32.64g铜与140mL一定浓度的硝酸反应,铜完全溶解,产生的NO和NO2混合气体在标准状况下的体积为11.2L(不考虑NO2的反应),试回答:
①若铜与硝刚好反应完全,则原硝酸溶液的物质的量浓度为
10.86mol﹒L-1
10.86mol﹒L-1
②将产生的气体全部释放后,向溶液中加入VmL amol?L-1的NaOH溶液,恰好使溶液中的Cu2+全部转化为沉淀,则原硝酸溶液的物质的量浓度为
| 10-3a﹒V +0.5 |
| 0.14 |
| 10-3a﹒V +0.5 |
| 0.14 |
③已知NO和NO2的混合气与足量氧气混合后能被水完全吸收成硝酸,则要使上述11.2L气体完全被水吸收成硝酸,理论上需消耗标准状况下的氧气
5.71
5.71
升.(保留两位小数);解题过程:设生成的一氧化氮为xmol,二氧化氮为ymol.
3Cu+8HNO3=3Cu(NO3 ) 2+2NO↑+4H2O
3 2
1.5xmol xmol
Cu+4HNO3(浓)=Cu(NO3 ) 2+2NO2↑+2H2O
1 2
ymol.ymol.
所以方程组为
所以
即一氧化氮为0.26mol,二氧化氮为0.24mol.
4NO+2H2O+3O2=4HNO3
4 3
0.26mol 0.195mol
4 NO2+2H2O+O2=4HNO3
41
0.24mol 0.06mol
所以需要氧气0.195mol+0.06mol=0.255mol,体积为0.255mol×22.4L/mol=5.71L
3Cu+8HNO3=3Cu(NO3 ) 2+2NO↑+4H2O
3 2
1.5xmol xmol
Cu+4HNO3(浓)=Cu(NO3 ) 2+2NO2↑+2H2O
1 2
| 1 |
| 2 |
所以方程组为
|
所以
|
即一氧化氮为0.26mol,二氧化氮为0.24mol.
4NO+2H2O+3O2=4HNO3
4 3
0.26mol 0.195mol
4 NO2+2H2O+O2=4HNO3
41
0.24mol 0.06mol
所以需要氧气0.195mol+0.06mol=0.255mol,体积为0.255mol×22.4L/mol=5.71L
设生成的一氧化氮为xmol,二氧化氮为ymol.
3Cu+8HNO3=3Cu(NO3 ) 2+2NO↑+4H2O
3 2
1.5xmol xmol
Cu+4HNO3(浓)=Cu(NO3 ) 2+2NO2↑+2H2O
1 2
ymol.ymol.
所以方程组为
所以
即一氧化氮为0.26mol,二氧化氮为0.24mol.
4NO+2H2O+3O2=4HNO3
4 3
0.26mol 0.195mol
4 NO2+2H2O+O2=4HNO3
41
0.24mol 0.06mol
所以需要氧气0.195mol+0.06mol=0.255mol,体积为0.255mol×22.4L/mol=5.71L
.3Cu+8HNO3=3Cu(NO3 ) 2+2NO↑+4H2O
3 2
1.5xmol xmol
Cu+4HNO3(浓)=Cu(NO3 ) 2+2NO2↑+2H2O
1 2
| 1 |
| 2 |
所以方程组为
|
所以
|
即一氧化氮为0.26mol,二氧化氮为0.24mol.
4NO+2H2O+3O2=4HNO3
4 3
0.26mol 0.195mol
4 NO2+2H2O+O2=4HNO3
41
0.24mol 0.06mol
所以需要氧气0.195mol+0.06mol=0.255mol,体积为0.255mol×22.4L/mol=5.71L