网址:http://m.1010jiajiao.com/timu3_id_268920[举报]
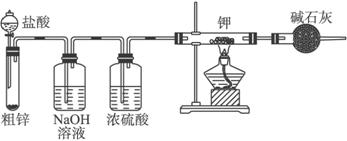
(1)请你评价实验方案,找出每套方案的优缺点,填写下表:
| 方案Ⅰ | 方案Ⅱ | 方案Ⅲ |
优点 |
|
|
|
缺点 |
|
|
|
(2)请你设计一套合理方案,并画出实验装置图。
(3)根据合理方案进行实验,其实验步骤如下:A.检查装置气密性;B.装药品;C.停止加热;D.打开分液漏斗的活塞;E.通一会儿气体;F.收集气体并检验气体纯度;G.关闭分液漏斗活塞;H.加热。
①正确的操作顺序是:__________(填编号,同一操作可以重复用);②检验气体纯度的目的是________________,③从安全角度考虑,尾气的正确处理方法是____________________。
(4)根据氢化钾(KH)的制备成为事实,你推测氢元素与下列哪些元素有相似的性质,并简述理由________________________________。
A.碳 B.氧 C.钠 D.氯 E.镁
查看习题详情和答案>>中学化学中氢元素常常在化合物中显+1价,但氢是非金属元素,是否也有负价呢?科学家经过研究,已合成了氢化钾、氢化钠等碱金属氢化物,其反应为:2K+H2 2KH。已知KH为白色固体,极易与水反应:KH+H2O=KOH+H2↑。某研究学习小组设计了下列三套方案:
2KH。已知KH为白色固体,极易与水反应:KH+H2O=KOH+H2↑。某研究学习小组设计了下列三套方案: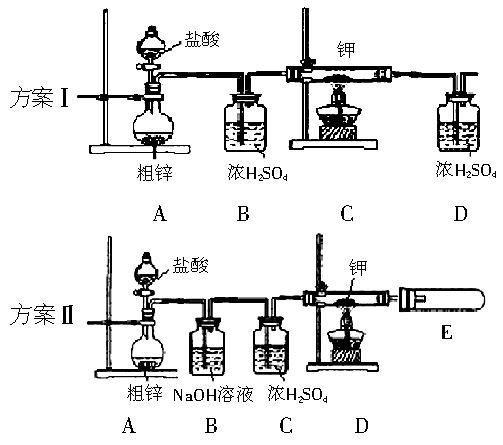
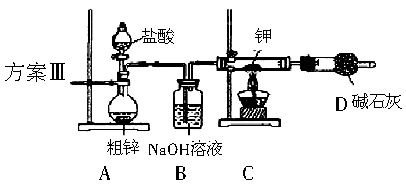
(1)请你评价三套实验方案,找出每套方案的优缺点,填入下表: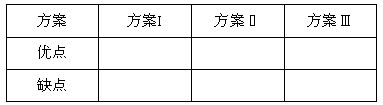
(2)请你设计一套合理方案,根据合理方案进行实验,其步骤如下:
A.检验装置气密性;B.装药品;C.停止加热;D.打开分液漏斗;E.通一会儿气体;F.收集并检验气体纯度;G.关闭分液漏斗活塞;H.加热
①正确的操作顺序是_________(填序号,同一操作可重复使用);②检验气体纯度的目的是_________;③从安全角度考虑,尾气的正确处理方法是_________
____________。
(3)根据制备氢和钾的化合物KH已成为事实,请你推测氢元素具备下列元素某些性质的是_________,理由是_________。
A.碳 B.氧 C.钠 D.氯 E.镁
①C+H2O
| ||
| ||
| ||
根据以上信息和有关知识,他们设计如下图所示的实验装置.

请回答下列问题:
(1)装置A中反应的离子方程式是
(2)装置B中最适宜的试剂是
(3)按照如图装置进行实验时,首先应进行的操作是
(4)根据该实验中的
| ||
| ||
(5)若要根据装置F中石灰水变浑浊的现象确认CO具有还原性,应在上图装置
(1)利用海水脱硫是一种有效的方法,其工艺流程如下图所示:
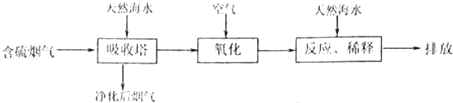
某研究小组为探究提高含硫烟气中SO2的吸收效率的措施,进行了天然海水吸收含硫烟气的模拟实验,实验结果如图1所示.
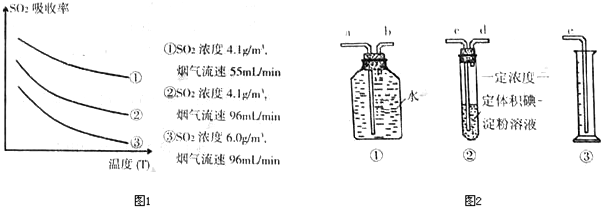
①根据图示实验结果,为了提高一定浓度含硫烟气中SO2的吸收效率,下列措施正确的是
A.降低通入含硫烟气的温度;B.减小通入含硫烟气的流速
C.减少天然海水的进入量;D.在天然海水中加入生石灰
②天然海水吸收了含硫烟气后会溶有H2SO3,使用空气中的氧气将其氧化,写出该反应的离子方程式
③该小组采用图2装置在实验室测定烟气中SO2的体积分数(假设实验在标准状况下进行):上述装置组装连接的顺序是:原料气→
A.酸性KMnO4溶液;B.NaOH溶液;C.溴水;D.氨水
(2)石灰石-石膏湿法烟气脱硫工艺技术的工作原理是烟气中的二氧化硫与浆液中的碳酸钙以及鼓入的空气反应生成石膏(CaSO4?2H2O).写出该反应的化学方程式:
 (2009?广东)甲酸甲酯水解反应方程式为:
(2009?广东)甲酸甲酯水解反应方程式为:HCOOCH3(l)+H2O(l)
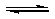 HCOOH(l)+CH3OH(l)△H>0
HCOOH(l)+CH3OH(l)△H>0某小组通过实验研究该反应(反应过程中体积变化忽略不计).反应体系中各组分的起始量如下表:
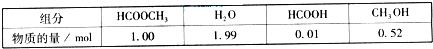
甲酸甲酯转化率在温度T1下随反应时间(t)的变化如下图:
(1)根据上述条件,计算不同时间范围内甲酸甲酯的平均反应速率,结果见下表:

请计算15~20min范围内甲酸甲酯的减少量为
(2)依据以上数据,写出该反应的反应速率在不同阶段的变化规律及其原因:
②反应中期:甲酸量逐渐增多,催化效果显著,反应速率明显增大.
③反应后期:甲酸量增加到一定程度后,浓度对反应速率的影响成主导因素,特别是逆反应速率的增大,使总反应速率逐渐减小,直至为零.
②反应中期:甲酸量逐渐增多,催化效果显著,反应速率明显增大.
③反应后期:甲酸量增加到一定程度后,浓度对反应速率的影响成主导因素,特别是逆反应速率的增大,使总反应速率逐渐减小,直至为零.
(3)上述反应的平衡常数表达式为:K=
| c(HCOOH)?c(CH3OH) |
| c(HCOOCH3)?c(H2O) |
| 1 |
| 7 |
| 1 |
| 7 |
(4)其他条件不变,仅改变温度为T2(T2大于T1),在答题卡框图中画出温度T2下甲酸甲酯转化率随反应时间变化的预期结果示意图.