网址:http://m.1010jiajiao.com/timu3_id_268861[举报]
(10分)随着人类对温室效应和资源短缺等问题的重视,如何降低大气中C02的含量及有效地开发利用CO2,引起了各国的普遍重视。
(1)下列关于C02的用途不正确的是 (填序号)。
A.二氧化碳能溶于水,可用于生产碳酸型饮料
B.固体二氧化碳俗称干冰,可用于人工降雨
C.二氧化碳用于灭火是因为降低了可燃物的着火点
D.超临界二氧化碳作萃取溶剂用于从天然产物提取和净化活性组分
E.二氧化碳可以作为气肥,提高农作物的产量
(2)目前工业上有一种方法是用C02来生产甲醇。为探究其反应原理,现进行如下实验,在体积为1L的密闭容器中,充入1 mol CO2和3 mol H2,一定条件下发生反应:C02(g)+
3 H2(g) ![]() CH30H(g)+H20(g) ΔH=-49.0kJ.m01-1,测得C02和CH3OH(g)的浓度随时间变化如图所示。
CH30H(g)+H20(g) ΔH=-49.0kJ.m01-1,测得C02和CH3OH(g)的浓度随时间变化如图所示。
①从反应开始到平衡,氢气的平均反应速率:v(H。)= 。
②该反应的平衡常数为 。
(3)以KHC03溶液为电解质,用电解的方法也可以将C02还原为甲醇。请写出电解时阴极的离子方程式:
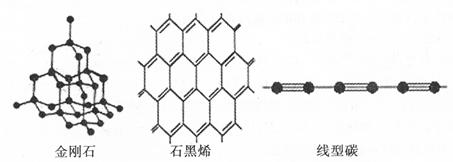
(4)金刚石、石墨烯、线型碳是碳的几种同素异形体。从键的类型分析它们的稳定性由强到弱的顺序为
查看习题详情和答案>>
(10分)随着人类对温室效应和资源短缺等问题的重视,如何降低大气中C02的含量及有效地开发利用CO2,引起了各国的普遍重视。
(1)下列关于C02的用途不正确的是 (填序号)。
A.二氧化碳能溶于水,可用于生产碳酸型饮料
B.固体二氧化碳俗称干冰,可用于人工降雨
C.二氧化碳用于灭火是因为降低了可燃物的着火点
D.超临界二氧化碳作萃取溶剂用于从天然产物提取和净化活性组分
E.二氧化碳可以作为气肥,提高农作物的产量
(2)目前工业上有一种方法是用C02来生产甲醇。为探究其反应原理,现进行如下实验,在体积为1L的密闭容器中,充入1 mol CO2和3 mol H2,一定条件下发生反应:C02(g)+
3 H2(g) 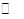 CH30H(g)+H20(g)
ΔH=-49.0kJ.m01-1,测得C02和CH3OH(g)的浓度随时间变化如图所示。
CH30H(g)+H20(g)
ΔH=-49.0kJ.m01-1,测得C02和CH3OH(g)的浓度随时间变化如图所示。

①从反应开始到平衡,氢气的平均反应速率:v(H。)= 。
②该反应的平衡常数为 。
(3)以KHC03溶液为电解质,用电解的方法也可以将C02还原为甲醇。请写出电解时阴极的离子方程式:
(4)金刚石、石墨烯、线型碳是碳的几种同素异形体。从键的类型分析它们的稳定性由强到弱的顺序为

查看习题详情和答案>>
(1)下列关于C02的用途不正确的是 (填序号)。
| A.二氧化碳能溶于水,可用于生产碳酸型饮料 |
| B.固体二氧化碳俗称干冰,可用于人工降雨 |
| C.二氧化碳用于灭火是因为降低了可燃物的着火点 |
| D.超临界二氧化碳作萃取溶剂用于从天然产物提取和净化活性组分 |
(2)目前工业上有一种方法是用C02来生产甲醇。为探究其反应原理,现进行如下实验,在体积为1L的密闭容器中,充入1 mol CO2和3 mol H2,一定条件下发生反应:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) ΔH=-49.0kJ.m01-1,测得C02和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g) ΔH=-49.0kJ.m01-1,测得C02和CH3OH(g)的浓度随时间变化如图所示。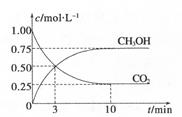
①从反应开始到平衡,氢气的平均反应速率:v(H。)= 。
②该反应的平衡常数为 。
(3)以KHC03溶液为电解质,用电解的方法也可以将CO2还原为甲醇。请写出电解时阴极的离子方程式:
(4)金刚石、石墨烯、线型碳是碳的几种同素异形体。从键的类型分析它们的稳定性由强到弱的顺序为
①及时转移疏散人群,同时向有关部门如实报告事故有关情况;②被转移人群应戴上用浓NaOH溶液处理过的口罩;③用高压水枪向空中喷洒含碱性物质的水溶液;④被转移人群可戴上用Na2CO3溶液处理过的口罩(湿润);⑤将人群转移到地势较低的地方即可,不必走太远;⑥及时清理现场,检查水源和食物等是否被污染;⑦常温下氯气能溶于水,所以只要向空气中喷洒水就可以解毒。
据报道,为防止罐中液氯再次泄漏,4月1日抢救人员将盛液氯的罐吊到事故发生地附近刚挖好的水塘中,用烧碱溶液处理。写出反应的离子方程式____________________________。
(2)用氯气对饮用水消毒已有百年历史。这种消毒方法会使饮用水中的有机物发生氯代,生成含氯的有机化合物,对人体有害,世界环保联盟即将全面禁止用氯气对饮用水消毒,建议推广采用广谱高效消毒剂二氧化氯(ClO2)。
我国最近研究成功了用氯气氧化亚氯酸钠(在氮气保护下)制得ClO2,表示这一反应的化学方程式是______________,在H2SO4的酸性条件下,用Na2SO3还原NaClO3也可制得ClO2,在以上反应中NaClO3和Na2SO3的物质的量之比为_______。
(3)一化学课外活动小组的同学制作了一种家用环保型消毒液发生器(如图1-3-3),用石墨作电极电解饱和氯化钠溶液,可制得少量消毒剂。为了研究各电极的产物,反应开始后沿玻璃管滴几滴酚酞试液到溶液中,发现上层溶液变红,一段时间后,红色消失。则与电源a端相连的电极上发生的电极反应式为____________________。

图1-3-3
该小组同学经查阅资料后认为褪色的原因可能有两个:一是氢氧化钠浓度过大;二是。小华设计了一个简单的实验,只需要一种试剂,便获得了有关褪色原因的结论,请简要写出小华设计的实验方案:______________________________________________________________。
查看习题详情和答案>>
(1)A是④的最高价含氧酸,其化学式为
(2)将③对应的单质投入A的稀溶液中,发生的反应属于
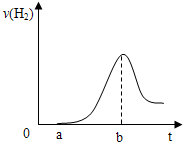
(3)把在空气中久置的③的单质投入A的稀溶液中,产生氢气的速率与反应时间的关系可用如图曲线表示:
曲线0→a段不产生氢气的原因是
曲线由b以后产生氢气速率逐渐减小的主要原因是
(4)①和②对应的单质在一个固定体积的密闭容器中发生可逆反应,该反应达到平衡的标志是