摘要:蜡烛燃烧后生成二氧化碳和水.由此你可以推测出蜡烛中肯定含有哪些元素? 思路解析:根据化学反应前后元素的种类不变.对于一些物质的组成.我们可以通过这种方法来测出物质中含有哪些元素.有时还可以把一种物质隔绝空气加强热.分析产物的成分.来得出该物质中含有哪些元素.我们可以从电解水的例子看出.在反应前后.原子的种类没有改变.不能得出.在反应前后.元素的种类也没有改变.蜡烛燃烧.其实质是与空气中的氧气发生反应.生成了二氧化碳和水.在生成物中.共有碳.氢.氧三种元素.那么在反应物中也有这三种元素.氧气中只含有氧元素.没有碳元素和氢元素.那碳元素和氢元素只能来自于蜡烛中.对于蜡烛中是否含有氧.不能确定. 答案:蜡烛中一定含有的元素是:碳元素和氢元素. 我创新 我超越
网址:http://m.1010jiajiao.com/timu3_id_26786[举报]
某课外小组查阅到:“过氧化钠(Na2O2)是种淡黄色粉末,它能和二氧化碳发生反应.同时放出大量热量”。于是他们设计了以下三个探究实验:
【实验l】用嘴通过玻璃管对着包有过氧化钠粉末的棉花吹气,发现棉花剧烈燃烧,燃烧后的灰烬溶于水,加入盐酸会产生能使澄清石灰水变浑浊的气体。据此推断过氧化钠和二氧化碳两种物质反应的化学方程式为 。
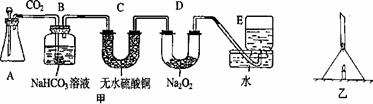
【实验2】按图甲所示完成装置连接(装置气密性良好)。A中装入稀盐酸和大理石,则B装置的作用是 ;反应一段时间后(此时样品仍呈淡黄色),将带火星的木条伸入E中收集到的气体,发现木条马上熄灭。于是他们对此展开争论:甲认为可能是二氧化碳过量,E中收集到的气体中含有大量二氧化碳;乙认为是二氧化碳被干燥后根本不能和过氧化钠反应,E中收集到的气体全部是二氧化碳。则 观点是正确的,为了证实这个观点,此时可以采取的简便验证方法是 。
【实验3】在证实上述观点后,他们又设计了一个实验,装置如图乙。将一团包有过氧化钠粉末的棉花塞在漏斗管中,下方点燃一支短蜡烛(蜡烛火焰与棉花不接触),则棉花会燃烧起来吗?并简要说明理由。
查看习题详情和答案>>我市某校研究性学习小组在老师指导下,对呼吸作用是否产生二氧化碳进行探究。现请你一同参与:
[提出问题]:呼吸作用是否产生二氧化碳?
(1)[设计方案并进行实验]:
小雪:在试管中加入2mL蒸馏水,用一支玻璃导管插入水中吹气,结果未发现明显的现象。
小宁:在试管中加入2mL澄清石灰水,用玻璃导管向试管中的溶液吹气,产生的现象是: ,该反应的化学反应文字表达式(或化学反应式)为: 。
[解释与结论]:小宁的结论为:呼吸作用能产生二氧化碳。
[评价与反思]:
(2)根据他们的方案和实验,若继续按小雪的方案实验,也能得到小宁同样的结论。请你帮小雪完成继续实验的方案(要求写出实验操作及产生的现象)。
[提出问题]:呼吸作用是否产生二氧化碳?
(1)[设计方案并进行实验]:
小雪:在试管中加入2mL蒸馏水,用一支玻璃导管插入水中吹气,结果未发现明显的现象。
小宁:在试管中加入2mL澄清石灰水,用玻璃导管向试管中的溶液吹气,产生的现象是: ,该反应的化学反应文字表达式(或化学反应式)为: 。
[解释与结论]:小宁的结论为:呼吸作用能产生二氧化碳。
[评价与反思]:
(2)根据他们的方案和实验,若继续按小雪的方案实验,也能得到小宁同样的结论。请你帮小雪完成继续实验的方案(要求写出实验操作及产生的现象)。

(3)在“奇妙的二氧化碳”的学习中同学们通常会完成“阶梯蜡烛实验”(如下图一所示)为研究方便“蜡烛与烧杯”的俯视图表示为如图三所示。为准确完成该实验,防范其他因素的干扰,通常会在将蜡烛点燃,再在烧杯中加一铁质的挡板(如图二所示)后,再向烧杯中倒入二氧化碳。

①实验中挡板放置位置,应当如下图 处表示的位置。(从下图中选“Ⅰ”或“Ⅱ” ,其中虚线表示为“挡板”放置的位置。)

②插入挡板后,应将二氧化碳气体倒入,请你从图四中选择合理倒入位置 (选填“A”、 “B”、 “C”或“D”)
③本实验的现象是 ;
④由上述实验现象可知二氧化碳的性质有:
查看习题详情和答案>>
③本实验的现象是 ;
④由上述实验现象可知二氧化碳的性质有: