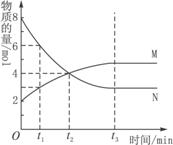
摘要:在一定的温度下.容器内某一反应中.M.N两种气体的物质的量随时间变化曲线如右图所示.下列表述中正确的是: A.t1时正反应速率小于逆反应速率 B. t2时正逆反应速率相等 C. t3时逆反应速率小于正反应速率 D.t4时刚好达到平衡
网址:http://m.1010jiajiao.com/timu3_id_267597[举报]
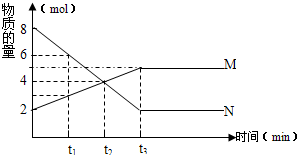 在一定温度下,容积为1L的密闭容器内,某一反应中M、N的物质的量随反应时间变化的曲线如图,
在一定温度下,容积为1L的密闭容器内,某一反应中M、N的物质的量随反应时间变化的曲线如图,请回答下列问题.
(1)该反应的化学方程式为:
2N (g)?M (g)
2N (g)?M (g)
(2)t1时生成M反应速率
大于
大于
(填“大于”“小于”或“等于”)消耗M反应速率(3)达到平衡状态的时间为
t3
t3
(填“t1”“t2”或“t3”),此时N的转化率为75%
75%
.(4)若生成M反应为吸热反应,在压强不变的情况下升高温度、容器的体积将
进行
进行
(填“增大”“减小”或“不变”) 在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如图,下列叙述正确的是( )
在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如图,下列叙述正确的是( )| A、反应的方程式为M?2N | B、t1时,N的浓度是M浓度的0.5倍 | C、t2时,正逆反应速率相等,达到平衡 | D、t3时,正反应速率大于逆反应速率 |
 在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如图,下列表述中正确的是( )
在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如图,下列表述中正确的是( )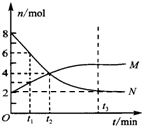 在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如图,下列表述中正确的是( )
在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如图,下列表述中正确的是( )