网址:http://m.1010jiajiao.com/timu3_id_266525[举报]
(1)Ni在元素周期表中的位置是______.
(2)镍易形成配合物,如:Ni(CO)4、[Ni(NH3)6]2+ 等.写出一种与配体CO互为等电子体的阴离子______.配体NH3中N原子的杂化类型为______,它可用作致冷剂的原因是______.若[Ni(NH3)6]2+ 为正八面体构型,则[Ni(CO)2(NH3)4]2+的结构有______种.
(3)镍常见化合价为+2、+3,在水溶液中通常只以+2 价离子的形式存在.+3价的镍离子具有很强的氧化性,在水中会与水或酸根离子迅速发生氧化还原反应.Ni3+的电子排布式为______,NiO(OH)溶于浓盐酸的化学方程式为______.
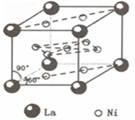
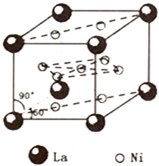
(4)镍和镧(
| 13957 |
LaNixHy+y NiO(OH)
| 放电 |
| 充电 |
 (2012?西安二模)镍(Ni)是一种重要的金属,在材料科学等领域有广泛应用.
(2012?西安二模)镍(Ni)是一种重要的金属,在材料科学等领域有广泛应用.(1)Ni在元素周期表中的位置是
(2)镍易形成配合物,如:Ni(CO)4、[Ni(NH3)6]2+ 等.写出一种与配体CO互为等电子体的阴离子
(3)镍常见化合价为+2、+3,在水溶液中通常只以+2 价离子的形式存在.+3价的镍离子具有很强的氧化性,在水中会与水或酸根离子迅速发生氧化还原反应.Ni3+的电子排布式为
(4)镍和镧(
139 57 |
LaNixHy+y NiO(OH)
| 放电 |
| 充电 |
 <化学--选修3:物质结构>
<化学--选修3:物质结构>镍(Ni)是一种重要的金属,在材料科学等领域有广泛应用.
(1)Ni在元素周期表中的位置是
(2)镍易形成配合物,如:Ni(CO)4、[Ni(NH3)6]2+ 等.写出一种与配体CO互为等电子体的阴离子
(3)镍常见化合价为+2、+3,在水溶液中通常只以+2 价离子的形式存在.+3价的镍离子具有很强的氧化性,在水中会与水或酸根离子迅速发生氧化还原反应.Ni3+的电子排布式为
(4)镍和镧(
139 57 |
(1)请写出下列化学方程式:
①SiCl4水解:_____________________________________________________;
②PCl5水解:______________________________________________________。
(2)Mg3N2及CaC2与水的反应也可看作水解,注意以下规律:
Mg3N2+6H2O![]() 3Mg(OH)2↓+2NH3↑
3Mg(OH)2↓+2NH3↑
CaC2+2H2O![]() Ca(OH)2+C2H2↑
Ca(OH)2+C2H2↑
写出下列化学方程式:
①Ca3P2与水反应:_________________________________________________;
②Mg
水解反应是广泛存在的一类反应,盐的水解即为一例。越弱越水解是盐水解的重要规律,如NaCl不水解,MgCl2水解,而同浓度的AlCl3水解程度比MgCl2高。从同周期中元素金属性递变规律看H4SiO4的酸性更弱,因而SiCl4水解更完全。
(1)请写出下列化学方程式:
①SiCl4水解:
________________________________________________________________________;
②PCl5水解:
________________________________________________________________________。
(2)Mg3N2及CaC2与水反应也可看做水解,注意以下规律:
Mg3N2+6H2O===3Mg(OH)2↓+2NH3↑
CaC2+2H2O===Ca(OH)2+C2H2↑
写出下列化学方程式:
①Ca3P2与水反应:
________________________________________________________________________;
②Mg3C2与水反应:
________________________________________________________________________。
查看习题详情和答案>>