题目内容
水解反应是广泛存在的一类反应,盐的水解即为一例。越弱越水解是盐水解的重要规律,如NaCl不水解,MgCl2水解,而同浓度的AlCl3水解程度比MgCl2高。从同周期中元素金属性递变规律看H4SiO4的酸性更弱,因而SiCl4水解更完全。(1)请写出下列化学方程式:
①SiCl4水解:_____________________________________________________;
②PCl5水解:______________________________________________________。
(2)Mg3N2及CaC2与水的反应也可看作水解,注意以下规律:
Mg3N2+6H2O![]() 3Mg(OH)2↓+2NH3↑
3Mg(OH)2↓+2NH3↑
CaC2+2H2O![]() Ca(OH)2+C2H2↑
Ca(OH)2+C2H2↑
写出下列化学方程式:
①Ca3P2与水反应:_________________________________________________;
②Mg
解析:水解反应的规律:盐中的阳离子部分与水中的氢氧根离子结合,剩余的部分结合,据此规律,可写出水解反应的方程式。
答案:(1)①SiCl4+4H2O![]() 4HCl+H4SiO4
4HCl+H4SiO4
②PCl5+4H2O![]() H3PO4+5HCl
H3PO4+5HCl
(2)①Ca3P2+6H2O![]() 3Ca(OH)2+2PH3↑
3Ca(OH)2+2PH3↑
②Mg![]() 3Mg(OH)2↓+C2H6↑
3Mg(OH)2↓+C2H6↑

练习册系列答案
 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案
相关题目
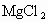 水解,而同浓度的
水解,而同浓度的 水解程度比
水解程度比 的酸性更弱,因而
的酸性更弱,因而 水解更完全.
水解更完全.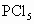 水解:__________________________.
水解:__________________________.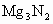 及
及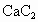 与水的反应也可看做水解,注意以下规律:
与水的反应也可看做水解,注意以下规律:

 与水反应:_______________________;
与水反应:_______________________; 与水反应:_______________________.
与水反应:_______________________.