网址:http://m.1010jiajiao.com/timu3_id_263785[举报]
2003年6月5日世界环境日的主题是:“水——二十亿人生命之所系”。节约用水,防治水污染具有十分重要的意义。某工厂有甲、乙、丙三个车间,各自排放的污水中均无沉淀物。各车间的污水分别含有以下六种物质中的各两种:KOH、K2SO4、AgNO3、Ba(NO3)2、KCl、HNO3。为防止污染水源,某中学化学兴趣小组配合工厂分别用石蕊试液和氯化钡溶液进行污水检测,现象如下:
甲:蓝色(石蕊试液)、白色沉淀(氯化钡溶液);乙:紫色(石蕊试液)、无明显现象(氯化钡溶液);丙:红色(石蕊试液)、白色沉淀(氯化钡溶液)。
由此可确定丙车间排放的污水中含有 和 。为变害为利,化学兴趣小组与工厂研究设计如下图污水处理方案。请回答:沉淀A是 ,若各步处理均完全反应,最终排放液C的溶质是 ,在农业上它可用作复合肥料。

⑵已知上述反应是放热反应,当该反应处于平衡状态时,在体积不变的条件下,下列措施中有利于提高SO2平衡转化率的有 (填字母)
(A)升高温度 (B)降低温度 (C)增大压强
(D)减小压强 (E)加入催化剂 (G)移出氧气 ⑶若2SO2(g)+O2(g)2SO3(g) ΔH=-197kJ·mol-1。现有甲、乙、丙三个相同的容积不变的容器,按下表中数据充入气体并反应达到平衡,放出或吸收的热量的数值分别为Q1、Q2、Q3。下列说法中不正确的是 。| 容器 | SO2(mol) | O2(mol) | SO3(mol) | 热量(kJ) |
| 甲 | 2 | 1 | 0 | Q1 |
| 乙 | 1 | 0.5 | 0 | Q2 |
| 丙 | 0 | 0 | 1 | Q3 |
D.2Q1 = 2Q2 < Q3 < 197kJ
⑷氨水吸收工业制硫酸尾气中的SO2的化学反应为:
下列措施中能提高燃煤烟气中去除率的有 (填字母)。
A.增大氨水浓度 B.升高反应温度
C.使燃煤烟气与氨水充分接触 D.通入空气使HSO3-转化为SO42-
查看习题详情和答案>>
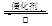 2SO3(g)。
⑴将0.050 mol SO2(g)和0.030 mol O2(g)放入容积为1 L的密闭容器中,在一定条件下达到平衡,测得c(SO3)=0.040 mol/L。则该条件下反应的平衡常数K= ,SO2的平衡转化率为 。
2SO3(g)。
⑴将0.050 mol SO2(g)和0.030 mol O2(g)放入容积为1 L的密闭容器中,在一定条件下达到平衡,测得c(SO3)=0.040 mol/L。则该条件下反应的平衡常数K= ,SO2的平衡转化率为 。
⑵已知上述反应是放热反应,当该反应处于平衡状态时,在体积不变的条件下,下列措施中有利于提高SO2平衡转化率的有 (填字母)
(A)升高温度 (B)降低温度 (C)增大压强
(D)减小压强 (E)加入催化剂 (G)移出氧气 ⑶若2SO2(g)+O2(g)2SO3(g) ΔH=-197kJ·mol-1。现有甲、乙、丙三个相同的容积不变的容器,按下表中数据充入气体并反应达到平衡,放出或吸收的热量的数值分别为Q1、Q2、Q3。下列说法中不正确的是 。| 容器 | SO2(mol) | O2(mol) | SO3(mol) | 热量(kJ) |
| 甲 | 2 | 1 | 0 | Q1 |
| 乙 | 1 | 0.5 | 0 | Q2 |
| 丙 | 0 | 0 | 1 | Q3 |
D.2Q1 = 2Q2 < Q3 < 197kJ
⑷氨水吸收工业制硫酸尾气中的SO2的化学反应为:
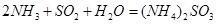
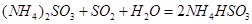
下列措施中能提高燃煤烟气中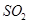 去除率的有
(填字母)。
去除率的有
(填字母)。
A.增大氨水浓度 B.升高反应温度
C.使燃煤烟气与氨水充分接触 D.通入空气使HSO3-转化为SO42-
查看习题详情和答案>>
甲:用10mL的量筒连续量取三次,每次量10mL。
乙:用100mL的量筒量取30mL。
丙:用50mL的量筒量取30mL。
你认为 操作正确,理由: 。
查看习题详情和答案>>SO2是硫酸生产的重要中间产物,也是空气污染的主要原因之一,其氧化生成SO3的反应为: 2SO2(g)+O2(g)![]() 2SO3(g)。
2SO3(g)。
⑴将0.050 mol SO2(g)和0.030 mol O2(g)放入容积为1 L的密闭容器中,在一定条件下达到平衡,测得c(SO3)=0.040 mol/L。则该条件下反应的平衡常数K= ,SO2的平衡转化率为 。
⑵已知上述反应是放热反应,当该反应处于平衡状态时,在体积不变的条件下,下列措施中有利于提高SO2平衡转化率的有 (填字母)
(A)升高温度 (B)降低温度 (C)增大压强
(D)减小压强 (E)加入催化剂 (G)移出氧气
⑶若2SO2(g)+O2(g)![]() 2SO3(g) ΔH=-197kJ·mol-1。现有甲、乙、丙三个相同的容积不变的容器,按下表中数据充入气体并反应达到平衡,放出或吸收的热量的数值分别为Q1、Q2、Q3。下列说法中不正确的是 。
2SO3(g) ΔH=-197kJ·mol-1。现有甲、乙、丙三个相同的容积不变的容器,按下表中数据充入气体并反应达到平衡,放出或吸收的热量的数值分别为Q1、Q2、Q3。下列说法中不正确的是 。
| 容器 | SO2(mol) | O2(mol) | SO3(mol) | 热量(kJ) |
| 甲 | 2 | 1 | 0 | Q1 |
| 乙 | 1 | 0.5 | 0 | Q2 |
| 丙 | 0 | 0 | 1 | Q3 |
A.Q1 = 2Q2 = 2Q3 = 197kJ
B.在上述反应中每消耗2mol SO2气体时放出的热量为197kJ
C.在上述反应中生成1mol SO3气体放热98.5kJ
D.2Q1 ??= 2Q2 < Q3 < 197kJ
⑷氨水吸收工业制硫酸尾气中的SO2的化学反应为:
![]()
![]()
下列措施中能提高燃煤烟气中![]() 去除率的有 (填字母)。
去除率的有 (填字母)。
A.增大氨水浓度 B.升高反应温度
C.使燃煤烟气与氨水充分接触 D.通入空气使HSO3-转化为SO42-
查看习题详情和答案>>