摘要:31.1:1,1:10,10x+y-14; 无作案:
网址:http://m.1010jiajiao.com/timu3_id_263563[举报]
燃煤废气中的氮氧化物(NOx)、二氧化碳等气体,常用下列方法处理,以实现节能减排、废物利用等.
(1)对燃煤废气进行脱硝处理时,常利用甲烷催化还原氮氧化物,如:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H=-574kJ?mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ?mol-1
则CH4(g)将NO2(g)还原为N2(g)等的热化学方程式为 .
(2)将燃煤废气中的CO2转化为甲醚的反应原理为:
2CO2(g)+6H2(g)
CH3OCH3(g)+3H2O(g)
已知一定压强下,该反应在不同温度、不同投料比时,CO2的转化率见下表:
①若温度升高,则反应的平衡常数K将 (填“增大”、“减小”或“不变”.下同);若温度不变,提高投料比[n(H2)/n(CO2)],则K将 .
②若用甲醚作为燃料电池的原料,请写出在碱性介质中电池负极的电极反应式 .
③在②所确定的电池中,若通入甲醚(沸点为-24.9℃)的速率为1.12L?min-1(标准状况),并以该电池作为电源电解2mol?L-1CuSO4溶液500mL,则通电30s后理论上在阴极可析出金属铜 g.
查看习题详情和答案>>
(1)对燃煤废气进行脱硝处理时,常利用甲烷催化还原氮氧化物,如:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H=-574kJ?mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ?mol-1
则CH4(g)将NO2(g)还原为N2(g)等的热化学方程式为
(2)将燃煤废气中的CO2转化为甲醚的反应原理为:
2CO2(g)+6H2(g)
| 催化剂 |
已知一定压强下,该反应在不同温度、不同投料比时,CO2的转化率见下表:
| 投料比[n(H2)/n(CO2)] | 500K | 600K | 700K | 800K |
| 1.5 | 45% | 33% | 20% | 12% |
| 2.0 | 60% | 43% | 28% | 15% |
| 3.0 | 83% | 62% | 37% | 22% |
②若用甲醚作为燃料电池的原料,请写出在碱性介质中电池负极的电极反应式
③在②所确定的电池中,若通入甲醚(沸点为-24.9℃)的速率为1.12L?min-1(标准状况),并以该电池作为电源电解2mol?L-1CuSO4溶液500mL,则通电30s后理论上在阴极可析出金属铜
为探究温度、压强对可逆反应A(g)+B(g)?C(g)+D(s)的影响,在起始容积为10L的密闭容器中充入1molA和1molB.分别进行了如下各组实验,各组实验的起始状态相同,②③④组是在①的基础上作出的改变,测得不同条件下平衡时各物质浓度见下表.第①组:保持温度不变;第②组:只改变体系体积;第③组:只升高温度;第④组:某同学只改变某一种实验条件测得的实验数据.
分析相关数据后,同学得出下列结论,其中正确的是( )
| A | B | C | |
| ① | 0.05mol?L-1 | amol?L-1 | 0.05mol?L-1 |
| ② | bmol?L-1 | bmol?L-1 | 0.122mol?L-1 |
| ③ | 0.06mol?L-1 | 0.06mol?L-1 | 0.04mol?L-1 |
| ④ | 0.07mol?L-1 | 0.07mol?L-1 | 0.098mol?L-1 |
| A、第①组实验中a=0.05mol?L-1 |
| B、第②组实验中,b<0.05mol?L-1 |
| C、由①与③组数据的比较,可判断出正反应是吸热反应 |
| D、由①与④组数据的比较,可判断该同学改变的条件不可能与温度有关 |
填空:
(1)在1~18号元素中,除稀有气体元素外:原子半径最大的元素是
(2)某元素的原子的价电子构型为4s24p1,它在周期表中的位置是
(3)C、N、O三种元素第一电离能从大到小的顺序是
(4)某元素+3价离子的3d轨道半充满,该元素为
 .
.
(5)在氯化钠晶体中,与每个Na+等距离且最近的几个Cl-所围成的空间几何构型为
查看习题详情和答案>>
(1)在1~18号元素中,除稀有气体元素外:原子半径最大的元素是
Na
Na
,电负性最大的元素是F
F
(用元素符号表示).(2)某元素的原子的价电子构型为4s24p1,它在周期表中的位置是
第4周期ⅢA族
第4周期ⅢA族
.(3)C、N、O三种元素第一电离能从大到小的顺序是
N>O>C
N>O>C
.(4)某元素+3价离子的3d轨道半充满,该元素为
Fe
Fe
(用元素符号表示);X原子在第二电子层上只有一个空轨道,则X是C
C
,其轨道表示式为

(5)在氯化钠晶体中,与每个Na+等距离且最近的几个Cl-所围成的空间几何构型为
正八面体
正八面体
.Ⅰ.在一定条件下,科学家利用从烟道气中分离出CO2与太阳能电池电解水产生的H2合成甲醇,其过程如图所示,试回答下列问题:
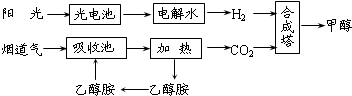
(1)该合成路线对于环境保护的价值在于 .
(2)15~20%的乙醇胺(HOCH2CH2NH2)水溶液具有弱碱性,上述合成线路中用作CO2吸收剂.用离子方程式表示乙醇胺水溶液呈弱碱性的原因 .
(3)CH3OH、H2的燃烧热分别为:△H=-725.5kJ/mol、△H=-285.8kJ/mol,写出工业上以CO2、H2合成CH3OH的热化学方程式: .
Ⅱ.将燃煤废气中的CO2转化为甲醚的反应原理为:
2CO2(g)+6H2(g)
CH3OCH3(g)+3H2O(g)
已知一定压强下,该反应在不同温度、不同投料比时,CO2的转化率见下表:
(4)该反应的焓变△H 0,熵变△S 0(填>、<或=).
(5)用甲醚作为燃料电池原料,在碱性介质中该电池负极的电极反应式 .若以1.12L?min-1(标准状况)的速率向该电池中通入甲醚(沸点为-24.9℃),用该电池电解500mL 2mol?L-1CuSO4溶液,通电0.50min后,理论上可析出金属铜 g.
查看习题详情和答案>>

(1)该合成路线对于环境保护的价值在于
(2)15~20%的乙醇胺(HOCH2CH2NH2)水溶液具有弱碱性,上述合成线路中用作CO2吸收剂.用离子方程式表示乙醇胺水溶液呈弱碱性的原因
(3)CH3OH、H2的燃烧热分别为:△H=-725.5kJ/mol、△H=-285.8kJ/mol,写出工业上以CO2、H2合成CH3OH的热化学方程式:
Ⅱ.将燃煤废气中的CO2转化为甲醚的反应原理为:
2CO2(g)+6H2(g)
| 催化剂 |
已知一定压强下,该反应在不同温度、不同投料比时,CO2的转化率见下表:
| 投料比[n(H2)/n(CO2)] | 500K | 600K | 700K | 800K |
| 1.5 | 45% | 33% | 20% | 12% |
| 2.0 | 60% | 43% | 28% | 15% |
| 3.0 | 83% | 62% | 37% | 22% |
(5)用甲醚作为燃料电池原料,在碱性介质中该电池负极的电极反应式
下列有关实验操作的说法正确的是( )
| A、用渗析法分离淀粉中混有的NaCl杂质 | B、用玻璃棒搅拌漏斗中的液体以加快过滤速率 | C、加入盐酸以除去硫酸钠中的少量碳酸钠杂质 | D、用量筒取5.00mL 10.0mol?L-1硫酸于50mL容量瓶中,加水稀释至刻度,可配制1.00mol?L-1硫酸 |