题目内容
| A | B | C | |
| ① | 0.05mol?L-1 | amol?L-1 | 0.05mol?L-1 |
| ② | bmol?L-1 | bmol?L-1 | 0.122mol?L-1 |
| ③ | 0.06mol?L-1 | 0.06mol?L-1 | 0.04mol?L-1 |
| ④ | 0.07mol?L-1 | 0.07mol?L-1 | 0.098mol?L-1 |
| A、第①组实验中a=0.05mol?L-1 |
| B、第②组实验中,b<0.05mol?L-1 |
| C、由①与③组数据的比较,可判断出正反应是吸热反应 |
| D、由①与④组数据的比较,可判断该同学改变的条件不可能与温度有关 |
B.根据①与②中的C浓度变化和平衡移动的影响因素判断b的值大小;
C.根据①与③中的浓度变化判断正反应是吸热还是放热反应;
D.根据①与④中的浓度变化和极性转化法判断该同学改变的条件.
B.②中C:0.122mol/L×10L>1mol,当温度不变,由①与②中C的比较,生成物C浓度增加,②只改变体系体积,只能为缩小体积,虽平衡向正向移动,但相对于体积影响仍为各物质的浓度相应增大为主,所以b>0.05,故B错误;
C.只升高温度后,反应物A、B的浓度增大,C的浓度减小,说明化学平衡向着逆向移动,可判断出正反应是放热反应,故C错误;
D.将C的浓度完全转化成A、B的浓度,A、B的浓度都为0.168mol/L,最初加入的A、B的物质的量浓度均为0.1mol/L,说明只能是缩小体积,不可能与温度有关,故D正确;
故选AD.

某兴趣小组为探究温度、压强对可逆反应A(g)+B(g)?C(g)+D(s)的影响,进行了如下实验:恒温条件下,往一个容积为1OL的密闭容器中充入1molA和1molB,反应达平衡时测得容器中各物质的物质的量浓度为[浓度1].然后改变外界条件又做了两组实验:①只升高温度;②只改变体系压强.分别测得新平衡时容器中各物质的物质的量浓度为[浓度2]、[浓度3].
|
某兴趣小组为探究温度、压强对可逆反应A(g)+B(g) ![]() C(g)+D(s)的影响,进行了如下实验:恒温条件下,往一个容积为10L的密闭容器中充入1molA和1molB,反应达平衡时测得容器中各物质的浓度为[浓度1]。然后改变外界条件又做了两组实验:①只升高温度;②只改变体系压强;分别测得新平衡时容器中各成分的浓度为[浓度2]、[浓度3]。
C(g)+D(s)的影响,进行了如下实验:恒温条件下,往一个容积为10L的密闭容器中充入1molA和1molB,反应达平衡时测得容器中各物质的浓度为[浓度1]。然后改变外界条件又做了两组实验:①只升高温度;②只改变体系压强;分别测得新平衡时容器中各成分的浓度为[浓度2]、[浓度3]。
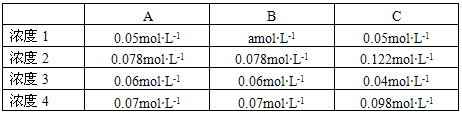
| A | B | C | |
| 浓度1 | 0.05mol?L-1 | amol?L-1 | 0.05mol?L-1 |
| 浓度2 | 0.078mol?L-1 | 0.078mol?L-1 | 0.122mol?L-1 |
| 浓度3 | 0.06mol?L-1 | 0.06mol?L-1 | 0.04mol?L-1 |
| 浓度4 | 0.07mol?L-1 | 0.07mol?L-1 | 0.098mol?L-1 |
请找出实验操作①②与实验数据[浓度2]、[浓度3]的对应关系,并分析下列结论,其中错误的是
A.由[浓度3]与[浓度1]的比较,可判断出正反应是放热反应
B.由[浓度2]与[浓度1]的比较,可判断平衡移动的原因是升高温度
C.[浓度1]中a=0.05mol?L-1
D.该组某学生在实验①过程中,测得各物质在某一时刻的浓度为[浓度4]。与[浓度1]比较,可发现该同学在测定[浓度4]这组数据时出现了很大的误差。
某兴趣小组为探究温度、压强对可逆反应A(g)+B(g) ![]() C(g)+D(s)的影响,进行了如下实验:恒温条件下,往一个容积为10L的密闭容器中充入1molA和1molB,反应达平衡时测得容器中各物质的浓度为[浓度1]。然后改变外界条件又做了两组实验:①只升高温度;②只改变体系压强;分别测得新平衡时容器中各成分的浓度为[浓度2]、[浓度3]。
C(g)+D(s)的影响,进行了如下实验:恒温条件下,往一个容积为10L的密闭容器中充入1molA和1molB,反应达平衡时测得容器中各物质的浓度为[浓度1]。然后改变外界条件又做了两组实验:①只升高温度;②只改变体系压强;分别测得新平衡时容器中各成分的浓度为[浓度2]、[浓度3]。
| A | B | C | |
| 浓度1 | 0.05mol·L-1 | amol·L-1 | 0.05mol·L-1 |
| 浓度2 | 0.078mol·L-1 | 0.078mol·L-1 | 0.122mol·L-1 |
| 浓度3 | 0.06mol·L-1 | 0.06mol·L-1 | 0.04mol·L-1 |
| 浓度4 | 0.07mol·L-1 | 0.07mol·L-1 | 0.098mol·L-1 |
请找出实验操作①②与实验数据[浓度2]、[浓度3]的对应关系,并分析下列结论,其中错误的是( )
A.由[浓度3]与[浓度1]的比较,可判断出正反应是放热反应
B.由[浓度2]与[浓度1]的比较,可判断平衡移动的原因是升高温度
C.[浓度1]中a=0.05mol·L-1
D.该组某学生在实验①过程中,测得各物质在某一时刻的浓度为[浓度4]与[浓度1]比较,可发现该同学在测定[浓度4]这组数据时出现了很大的误差。
 C(g)+D(s)的影响,进行了如下实验:恒温条件下,往一个容积为10L的密闭容器中充入1molA和1molB,反应达平衡时测得容器中各物质的浓度为[浓度1]。然后改变外界条件又做了两组实验:①只升高温度;②只改变体系压强;分别测得新平衡时容器中各成分的浓度为[浓度2]、[浓度3]。
C(g)+D(s)的影响,进行了如下实验:恒温条件下,往一个容积为10L的密闭容器中充入1molA和1molB,反应达平衡时测得容器中各物质的浓度为[浓度1]。然后改变外界条件又做了两组实验:①只升高温度;②只改变体系压强;分别测得新平衡时容器中各成分的浓度为[浓度2]、[浓度3]。