网址:http://m.1010jiajiao.com/timu3_id_263500[举报]
(Ⅰ)下列实验操作或对实验事实的描述正确的是 (填序号);
① 实验室配制氯化亚铁溶液时,将氯化亚铁先溶解在盐酸中,然后用蒸馏水稀释并加入少量铁粉。
② 配制一定浓度的溶液时,俯视容量瓶的刻度线,会使配制的浓度偏高;实验室测定中和热时,过早读数会使测定结果偏低。
③ 将Fe2(SO4)3溶液加热蒸发至干并灼烧,最后得到红棕色粉末
④ 实验室用铜片与稀硝酸反应产生的气体可用排水法收集
⑤ 试管中加入少量淀粉,再加入一定量稀硫酸,加热3-4分钟,然后加入银氨溶液,片刻后管壁上有“银镜”出现
⑥ 向氨水中滴加Al2(SO4)3溶液和向Al2(SO4)3溶液中滴加氨水现象相同
⑦ 苯与溴水在铁粉的催化作用下制备溴苯
⑧ 分别向体积和pH均相同的盐酸和醋酸中滴加等浓度的氢氧化钠溶液,完全中和时消耗的氢氧化钠溶液的体积一样多
Ⅱ.在中学化学实验中,通常用无水硫酸铜来检验少量水的存在。由于无水硫酸铜吸湿性很强,需要现制现用。
方法甲:取2药匙细小的硫酸铜晶体置于_______中研碎后放入坩埚,将坩埚放在______上用小火慢慢加热并用玻璃棒不停搅拌,最后将坩埚移入___________中进行冷却(请选用合适仪器填空:表面皿、研钵、烧杯、通风橱、试管夹、干燥器、泥三角)。
方法乙:取2药匙研碎的硫酸铜晶体于小烧杯中,加入20 mL浓硫酸(质量分数不低于98%),并用玻璃棒搅拌,静置5 min后倾去浓硫酸,用无水乙醇洗涤数次,倒在滤纸上晾干。
【交流与讨论】
(1)方法甲中,加热温度稍高时会出现变黑现象,原因是_________(用化学方程式表示)。
(2)方法乙中,浓硫酸的作用是__________;为了不浪费药品,对无水乙醇洗涤液进行再生的方法是______ ,所用的主要玻璃仪器有烧瓶、接液管、锥形瓶、酒精灯________________等。
(3)用制得的无水硫酸铜检验某双氧水中是否含水时,除了发现固体变蓝外,还发现该双氧水中有气泡产生,对此你有何猜想______________。
 (4)目前工业上正积极探索用浓HNO3作氧化剂,用Cu与浓H2SO4、浓HNO3反应,采取间歇加热、逐渐加入浓HNO3的方法来制备CuSO4•5H2O的新工艺。模拟制备装置如下图所示。
(4)目前工业上正积极探索用浓HNO3作氧化剂,用Cu与浓H2SO4、浓HNO3反应,采取间歇加热、逐渐加入浓HNO3的方法来制备CuSO4•5H2O的新工艺。模拟制备装置如下图所示。
【问题一】如图装置中,分液漏斗内装的液体是________,反应结束时,获取CuSO4•5H2O的操作过程是先________________,趁热将三颈瓶中的液体倒入烧杯中冷却,析出晶体CuSO4?5H2O ,过滤、晾干。
【问题二】工业上用石灰乳吸收尾气,除了防止环境污染外,还能得到了有经济实用价值的副产品―― 亚硝酸钙。尾气吸收生成亚硝酸钙的化学方程式是_______________。
查看习题详情和答案>>
(1)若有1molFeS2参加反应,转移电子的物质的量为_________________。
(2)硫酸生产中,SO2催化氧化生成SO3:

已知T℃时,SO2的平衡转化率(α)与体系总压强(P)的关系如图所示。根据图回答下列问题:

②T℃时,平衡由A点变到B点时,平衡常数K(A)_____K(B) (填“>”、“<”或“=”)。
③已知1g二氧化硫完全反应生成气态三氧化硫,放出热量 1.536kJ,则上述反应的反应热△H=_______________ 。
(3)某科研小组利用原电池原理,用SO2、O2和H2O来制备硫酸,装置如图,电极A、B为多孔的材料,能吸附气体,同时也能使气体与电解质溶液充分接触。请问

②溶液中H+的移动方向是由_____极池到_____极池(填A、B)。
| ||
(1)若有1mol FeS2参加反应,转移电子的物质的量为______.
(2)硫酸生产中,SO2催化氧化生成SO3:2SO2(g)+O2(g)
| ||
已知T℃时,SO2的平衡转化率(α)与体系总压强(P)的关系如图.根据图回答下列问题:
①T℃时,将2.0mol SO2和1.0mol O2置于10L密闭恒容反应器中,反应达平衡后,体系总压强为0.10MPa,计算该反应的平衡常数(写出计算过程,计算结果保留两位有效数字):______.
②T℃时,平衡由A点变到B点时,平衡常数K(A)______K(B)(填“>”、“<”或“=”).
③已知1g二氧化硫完全反应生成气态三氧化硫,放出热量1.536kJ,则上述反应的反应热△H=______.(保留小数点后一位)
(3)某科研小组利用原电池原理,用SO2、O2和H2O来制备硫酸,装置如图,电极A、B为多孔的材料,能吸附气体,同时也能使气体与电解质溶液充分接触.请问:
①B电极的电极反应为______;
②溶液中H+的移动方向是由______极池到______极池(填A、B).

(1)工业上有一种生产甲醇的反应:
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ?mol-1
在某温度下,容积均为1L的A、B两个容器中,按不同方式投入反应物,保持恒温恒容,经10秒钟后达到平衡,达到平衡时的有关数据如下表:
| 容器 | A | B |
| 反应物投入量 | 1mol CO2(g)和3mol H2(g) | 1mol CH3OH(g)和1mol H2O(g) |
| CH3OH(g)浓度(mol?L-1) | c1 | c2 |
| 反应能量变化 | 放出29.4kJ | 吸收akJ |
②该温度下,反应CO2(g)+3H2(g)?CH3OH(g)+H2O(g) 的化学平衡常数的值为______.
③a=______.
④下列措施中能使n(CH3OH)/n(CO2)增大的是______.
A.升高温度 B.充入氢气
C.将水蒸气从体系中分离 D.用更有效的催化剂
(2)某同学设计了一个甲醇燃料电池,并用该电池电解200mL一定浓度的NaCl与CuSO4混合溶液,其装置如图1:
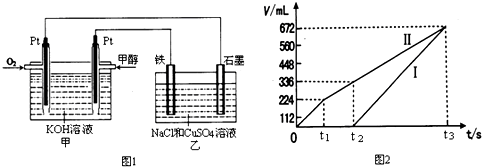
①写出甲中通入甲醇一极的电极反应式______.
②图2中曲线Ⅰ、Ⅱ分别表示乙中两极所得气体的体积随时间变化的关系(气体体积已换算成标准状况下的体积),写出电解开始时铁极上的电极反应式______;
t1后石墨电极上的电极反应式______;计算在t2时所得溶液的pH为(忽略电解前后溶液体积的变化)______.