摘要:用石墨作电极点解100mLH2SO4和CuSO4的混合溶液.通电一段时间后.两极均收集到4.48L气体.求原混合溶液中Cu2+的物质的量浓度.
网址:http://m.1010jiajiao.com/timu3_id_260182[举报]
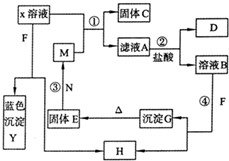 (2009?滨州模拟)已知X为中学化学中一种常见的盐,F为淡黄色固体;M、N为常见的金属,N的氧化物可作耐火材料,可用它来制造耐火坩埚和耐高温试验仪器;H为气体单质,D为无色气体,D在空气中会出现红棕色.各物质的转化关系如图(部分反应产物已略去).
(2009?滨州模拟)已知X为中学化学中一种常见的盐,F为淡黄色固体;M、N为常见的金属,N的氧化物可作耐火材料,可用它来制造耐火坩埚和耐高温试验仪器;H为气体单质,D为无色气体,D在空气中会出现红棕色.各物质的转化关系如图(部分反应产物已略去).请回答下列问题;
(1)E的化学式为
Fe2O3
Fe2O3
(2)将M丝插入盛有X溶液的试管中,反应一段时间后的现象是
铁丝上附有红色物质,溶液颜色逐渐变为浅绿色
铁丝上附有红色物质,溶液颜色逐渐变为浅绿色
.(3)在反应①②③④中属于置换反应的是
①③
①③
(填序号)(4)反应②的离子方程式为
3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O
3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O
.(5)用石墨作电极点解500mLX溶液,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成;点解一段时间后,取出A电极,洗涤、干燥、称量,电极增重1.6g.请回答下列问题:
①写出点解时的阳极反应式
4OH--4e-=O2↑+2H2O
4OH--4e-=O2↑+2H2O
.②电解后溶液的pH为
1
1
(假设电解前后溶液体积不变).(12分)已知X为中学化学中一种常见的盐,F为淡黄色固体;M、N为常见的金属,N的氧化物可作耐火材料,可用它来制造耐火坩埚和耐高温试验仪器;H为气体单质,D为无色气体,D在空气中会出现红棕色。各物质的转化关系如X下图(部分反应产物已略去)。

请回答下列问题;
(1) E的化学式为
(2) 将M丝插入盛有X溶液的试管中,反应一段时间后的现象是 。
(3) 在反应①②③④中属于置换反应的是 (填序号)
(4) 反应②的离子方程式为 。
(5) 用石墨作电极点解500mLX溶液,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成;点解一段时间后,取出A电极,洗涤、干燥、称量,电极增重1.6g。请回答下列问题:
①写出点解时的阳极反应式 。
②电解后溶液的pH为 (假设电解前后溶液体积不变)。
查看习题详情和答案>>
已知X为中学化学中一种常见的盐,F为淡黄色固体;M、N为常见的金属,N的氧化物可作耐火材料,可用它来制造耐火坩埚和耐高温试验仪器;H为气体单质,D为无色气体,D在空气中会出现红棕色.各物质的转化关系如图(部分反应产物已略去).
请回答下列问题;
(1)E的化学式为______
(2)将M丝插入盛有X溶液的试管中,反应一段时间后的现象是______.
(3)在反应①②③④中属于置换反应的是______(填序号)
(4)反应②的离子方程式为______.
(5)用石墨作电极点解500mLX溶液,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成;点解一段时间后,取出A电极,洗涤、干燥、称量,电极增重1.6g.请回答下列问题:
①写出点解时的阳极反应式______.
②电解后溶液的pH为______(假设电解前后溶液体积不变).
 查看习题详情和答案>>
查看习题详情和答案>>
请回答下列问题;
(1)E的化学式为______
(2)将M丝插入盛有X溶液的试管中,反应一段时间后的现象是______.
(3)在反应①②③④中属于置换反应的是______(填序号)
(4)反应②的离子方程式为______.
(5)用石墨作电极点解500mLX溶液,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成;点解一段时间后,取出A电极,洗涤、干燥、称量,电极增重1.6g.请回答下列问题:
①写出点解时的阳极反应式______.
②电解后溶液的pH为______(假设电解前后溶液体积不变).
 查看习题详情和答案>>
查看习题详情和答案>>
某研究小组模拟工业无隔膜电解法处理电镀含氰废水,进行以下有关实验,回答下列问题.
(1)实验I 制取次氯酸钠溶液,用石墨作电极电解饱和氯化钠溶液制取次氯酸钠溶液,生成次氯酸钠的离子方程式为 .
实验Ⅱ测定含氰废水处理百分率,利用如图所示装置进行实验:将CN-的浓度为0.2000mol?L-1的含氰废水100mL与l00mL NaClO溶液(过量)置于装置②锥形瓶中充分反应,打开分液漏斗活塞,滴入100ml,稀H2SO4,关闭活塞.
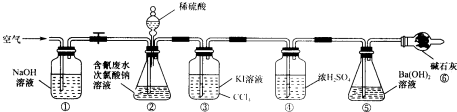
已知装置②中发生的主要反应依次为:
CN-+ClO-═CNO+Cl-
2CNO-+2H++3ClO-═N2↑+2CO2↑+3Cl-+H2O
(2)装置③的作用是 ,装置⑥的作用是 .
(3)反应结束后,缓缓通入空气的目的是 .
(4)为计算该实验中含氰废水被处理的百分率,需要测定 的质量.
(5)上述实验完成后,为了回收装置③中的CCl4需要的操作是 .
(6)若要研究装置②中所加稀硫酸的最佳浓度,请填写该装置进行实验的记录表.要求:①在进行理论判断后,将理论浓度作为第一组实验数据;②记录表要体现实验过程中的不变量、自变量、因变量.
查看习题详情和答案>>
(1)实验I 制取次氯酸钠溶液,用石墨作电极电解饱和氯化钠溶液制取次氯酸钠溶液,生成次氯酸钠的离子方程式为
实验Ⅱ测定含氰废水处理百分率,利用如图所示装置进行实验:将CN-的浓度为0.2000mol?L-1的含氰废水100mL与l00mL NaClO溶液(过量)置于装置②锥形瓶中充分反应,打开分液漏斗活塞,滴入100ml,稀H2SO4,关闭活塞.

已知装置②中发生的主要反应依次为:
CN-+ClO-═CNO+Cl-
2CNO-+2H++3ClO-═N2↑+2CO2↑+3Cl-+H2O
(2)装置③的作用是
(3)反应结束后,缓缓通入空气的目的是
(4)为计算该实验中含氰废水被处理的百分率,需要测定
(5)上述实验完成后,为了回收装置③中的CCl4需要的操作是
(6)若要研究装置②中所加稀硫酸的最佳浓度,请填写该装置进行实验的记录表.要求:①在进行理论判断后,将理论浓度作为第一组实验数据;②记录表要体现实验过程中的不变量、自变量、因变量.
| 实验 | c(H2SO4)mol.L-1 | V(H2SO4)mL | V(NaClO)mL | 含氯废水的体积mL |
| 1 | 100 | 100 | ||
| 2 | 0.0500 | 100 | 100 | |
| 3 | 0.2000 | 100 | 100 |