摘要:6.AD 提示:化学式变形.水是不耗氧的.
网址:http://m.1010jiajiao.com/timu3_id_256584[举报]
掌握电解质和非电解质的概念,能熟练判断一种物质是不是电解质是认识电解质的性质、研究离子反应的前提.以下有10种物质:①铜 ②稀硫酸 ③氯化氢 ④氨气 ⑤空气 ⑥二氧化碳 ⑦金属汞(俗称水银) ⑧氯化钠 ⑨碳酸钙 ⑩氯气
按照表中提示的信息,把符合左栏条件的物质的 化学式或名称填入右栏相应的位置
查看习题详情和答案>>
按照表中提示的信息,把符合左栏条件的物质的 化学式或名称填入右栏相应的位置
| 符合的条件 | 物质的化学式或名称 | |
| (1) | 混合物 | 稀硫酸、空气 稀硫酸、空气 |
| (2) | 电解质,但熔融状态下并不导电 | HCl HCl |
| (3) | 电解质,但难溶于水 | CaCO3 CaCO3 |
| (4) | 非电解质 | NH3、CO2 NH3、CO2 |
| (5) | 既不是电解质,也不是 非电解质,但本身能导电 |
Cu、Hg、稀硫酸 Cu、Hg、稀硫酸 |
下图虚线框内的其它转化是为探究C的组成而设.某新型无机非金属材料K由两种短周期元素组成.G、F、H均为难溶于水的白色固体;图中C、D、K均为含A元素.单质A中所含元素在地球表面的地壳中的含量排第二.其余物质均为中学化学中常见物质.(提示:NH3和H2O、NH2-、OH-的化学性质在某些方面相似.)

请回答下列问题:
(1)在磨口玻璃塞成分中含物质H,在实验室保存碱液
(2)标准状况下,11.2L气体单质B溶于NaOH溶液中,转移的电子数目为
(3)写出化学式:化合物C
(4)写出图中下列序号的离子方程式:
反应④
反应⑤
查看习题详情和答案>>

请回答下列问题:
(1)在磨口玻璃塞成分中含物质H,在实验室保存碱液
不能
不能
(“能”或“不能”)用磨口玻璃塞,请用化学方程式和简要的文字叙述其原因:SiO2+2NaOH═Na2SiO3+H2O,生成的Na2SiO3溶液有粘性
SiO2+2NaOH═Na2SiO3+H2O,生成的Na2SiO3溶液有粘性
(2)标准状况下,11.2L气体单质B溶于NaOH溶液中,转移的电子数目为
0.5NA
0.5NA
(3)写出化学式:化合物C
SiCl4
SiCl4
,化合物FH4SiO4(或H2SiO3)
H4SiO4(或H2SiO3)
.(4)写出图中下列序号的离子方程式:
反应④
Ag++Cl-═AgCl↓
Ag++Cl-═AgCl↓
;反应⑤
SiO2+2OH-=SiO32-+H2O
SiO2+2OH-=SiO32-+H2O
. A、B、D、E是短周期中构成蛋白质的重要元素,其性质见下表.Fe、Co元素的常见化合价为+2、+3,能形成各种有色配离子.
A、B、D、E是短周期中构成蛋白质的重要元素,其性质见下表.Fe、Co元素的常见化合价为+2、+3,能形成各种有色配离子.| A | B | D | E | |
| 化合价 | -4 | -2 | -3 | -2 |
| 电负性 | 2.5 | 2.5 | 3.0 | 3.5 |
1s22s22p63s23p63d64s2
1s22s22p63s23p63d64s2
.(2)Fe、Co两元素的第三电离能I3(Fe)
<
<
I3(Co)(填“<”或“>”).(3)B、D、E的气态氢化物的沸点由高到低的顺序为
H2O>NH3>H2S
H2O>NH3>H2S
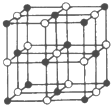
(填化学式).(4)Co与E形成的化合物晶胞如右图所示,则该化合物的化学式为
CoO
CoO
.(用元素符号表示)(5)Co的离子能与AD-离子生成各种配合物.紫色的配离子[Co(AD)6]4- 是一种相当强的还原剂,在加热时能与水反应生
成[Co(AD)6]3-.
①HAD分子中A元素的杂化类型为
sp
sp
,D元素的化合价为-3
-3
②写出[Co(AD)6]4-在加热时与水反应生成[Co(AD)6]3-的离子方程式:
2[Co(CN)6]4-+2H2O
2[Co(CN)6]3-+H2↑+2OH-
| ||
2[Co(CN)6]4-+2H2O
2[Co(CN)6]3-+H2↑+2OH-
.
| ||
Ⅰ. 已知某工业废水中含有大量的CuSO4,少量的Ag+、Hg2+以及部分污泥,通过下述过程可从该废水中回收硫酸铜晶体及其他物质.

(1)步骤1需用到的玻璃仪器除烧杯外有
(2)步骤2中需加入某种试剂后再将混合物分离,该试剂是(填化学式)
(3)步骤3中涉及的操作是:蒸发浓缩、
(4)步骤2应该在通风橱中进行,原因是
Ⅱ.((2)为1分,其余每空2分)某溶液中含有Na+、SO42-、SO32-、CO32-、Cl-、Br-中的若干种,依次进行下列实验,观察到的现象记录如下:①加入盐酸,有无色气体生成;②向原溶液中滴加氯水,无气体产生,再加CCl4振荡,静置,CCl4层呈橙色,用分液漏斗分液;③向分液后所得的水溶液中加入Ba(NO3)2和HNO3的混合溶液,有白色沉淀生成,过滤;④在滤液中加AgNO3和HNO3的混合液,有白色沉淀产生.试回答:(提示:氯气会氧化SO32-为SO42-)
(1)原溶液中肯定存在的离子是
(2)若步骤③改用BaCl2和盐酸的混合溶液,对判断(1)结论有无影响
(3)步骤②中发生反应的离子方程式为
查看习题详情和答案>>

(1)步骤1需用到的玻璃仪器除烧杯外有
漏斗、玻璃棒
漏斗、玻璃棒
.(2)步骤2中需加入某种试剂后再将混合物分离,该试剂是(填化学式)
Cu
Cu
,固体残渣的成分是(填化学式)Ag、Cu
Ag、Cu
.(3)步骤3中涉及的操作是:蒸发浓缩、
冷却结晶
冷却结晶
、过滤、烘干.(4)步骤2应该在通风橱中进行,原因是
因为Hg有挥发性,且有毒
因为Hg有挥发性,且有毒
.Ⅱ.((2)为1分,其余每空2分)某溶液中含有Na+、SO42-、SO32-、CO32-、Cl-、Br-中的若干种,依次进行下列实验,观察到的现象记录如下:①加入盐酸,有无色气体生成;②向原溶液中滴加氯水,无气体产生,再加CCl4振荡,静置,CCl4层呈橙色,用分液漏斗分液;③向分液后所得的水溶液中加入Ba(NO3)2和HNO3的混合溶液,有白色沉淀生成,过滤;④在滤液中加AgNO3和HNO3的混合液,有白色沉淀产生.试回答:(提示:氯气会氧化SO32-为SO42-)
(1)原溶液中肯定存在的离子是
Na+、SO32-、Br-
Na+、SO32-、Br-
,肯定没有的离子是CO32-
CO32-
;(2)若步骤③改用BaCl2和盐酸的混合溶液,对判断(1)结论有无影响
无影响
无影响
;(3)步骤②中发生反应的离子方程式为
Cl2+2Br-═Br2+2Cl-
Cl2+2Br-═Br2+2Cl-
、Cl2+SO32-+H2O═2Cl-+SO42-+2H+
Cl2+SO32-+H2O═2Cl-+SO42-+2H+
.(2009?吉林模拟)短周期元素A、B、C、D原子序数依次增大,其中只有一种为金属元素.A、C同主族,B的最外层电子数为次外层的3倍.B、C的最外层电子数之和与D的最外层电子数相等.
(1)写出D的最高价氧化物对应水化物的化学式
(2)C2B2的电子式为
 ,其中含有的化学键类型为
,其中含有的化学键类型为
(3)由上述四种元素中的任意三种可以组成两种常见化合物,水溶液均显碱性,D的单质可以与其中一种化合物反应生成另外一种化合物.写出该反应的离子方程式
(4)用石墨电极电解CD的饱和溶液,反应的离子方程式为
(5)在通常状况下,若1gA气体在D气体中燃烧生成AD气体时放出92.3kJ热量,则2mol AD气体完全分解生成A气体和D气体的热化学方程式为
查看习题详情和答案>>
(1)写出D的最高价氧化物对应水化物的化学式
HClO4
HClO4
;(2)C2B2的电子式为


离子键和非极性共价键
离子键和非极性共价键
;(3)由上述四种元素中的任意三种可以组成两种常见化合物,水溶液均显碱性,D的单质可以与其中一种化合物反应生成另外一种化合物.写出该反应的离子方程式
Cl2+2OH-═Cl-+ClO-+H2O
Cl2+2OH-═Cl-+ClO-+H2O
;(4)用石墨电极电解CD的饱和溶液,反应的离子方程式为
2Cl-+2H2O
Cl2+H2+2OH-
| ||
2Cl-+2H2O
Cl2+H2+2OH-
;
| ||
(5)在通常状况下,若1gA气体在D气体中燃烧生成AD气体时放出92.3kJ热量,则2mol AD气体完全分解生成A气体和D气体的热化学方程式为
2HCl(g)═H2(g)+Cl2(g)△H=+184.6kJ/mol
2HCl(g)═H2(g)+Cl2(g)△H=+184.6kJ/mol
.