题目内容
 A、B、D、E是短周期中构成蛋白质的重要元素,其性质见下表.Fe、Co元素的常见化合价为+2、+3,能形成各种有色配离子.
A、B、D、E是短周期中构成蛋白质的重要元素,其性质见下表.Fe、Co元素的常见化合价为+2、+3,能形成各种有色配离子.| A | B | D | E | |
| 化合价 | -4 | -2 | -3 | -2 |
| 电负性 | 2.5 | 2.5 | 3.0 | 3.5 |
1s22s22p63s23p63d64s2
1s22s22p63s23p63d64s2
.(2)Fe、Co两元素的第三电离能I3(Fe)
<
<
I3(Co)(填“<”或“>”).(3)B、D、E的气态氢化物的沸点由高到低的顺序为
H2O>NH3>H2S
H2O>NH3>H2S
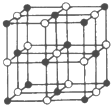
(填化学式).(4)Co与E形成的化合物晶胞如右图所示,则该化合物的化学式为
CoO
CoO
.(用元素符号表示)(5)Co的离子能与AD-离子生成各种配合物.紫色的配离子[Co(AD)6]4- 是一种相当强的还原剂,在加热时能与水反应生
成[Co(AD)6]3-.
①HAD分子中A元素的杂化类型为
sp
sp
,D元素的化合价为-3
-3
②写出[Co(AD)6]4-在加热时与水反应生成[Co(AD)6]3-的离子方程式:
2[Co(CN)6]4-+2H2O
2[Co(CN)6]3-+H2↑+2OH-
| ||
2[Co(CN)6]4-+2H2O
2[Co(CN)6]3-+H2↑+2OH-
.
| ||
分析:A、B、D、E是短周期中构成蛋白质的重要元素,应为C、H、O、N、S等元素,由表中化合价和电负性可知,A应为C,D应为N,B和E的化合价都为-2价,且电负性E>B,则B为S,E为O,
(1)Fe的原子数序为26,结合能量最低原理书写电子排布式;
(2)Fe、Co核外电子排布式分别为[Ar]3d64s2、[Ar]3d74s2,其第三电离能Fe的较小;
(3)结合氢键和物质的存在的状态判断;
(4)利用均摊法判断;
(5)①根据δ键数目判断杂化类型,根据电负性大小结合化学价代数和为0计算;
②根据化合价变化判断反应类型并判断产物,以此书写方程式.
(1)Fe的原子数序为26,结合能量最低原理书写电子排布式;
(2)Fe、Co核外电子排布式分别为[Ar]3d64s2、[Ar]3d74s2,其第三电离能Fe的较小;
(3)结合氢键和物质的存在的状态判断;
(4)利用均摊法判断;
(5)①根据δ键数目判断杂化类型,根据电负性大小结合化学价代数和为0计算;
②根据化合价变化判断反应类型并判断产物,以此书写方程式.
解答:解:A、B、D、E是短周期中构成蛋白质的重要元素,应为C、H、O、N、S等元素,由表中化合价和电负性可知,A应为C,D应为N,B和E的化合价都为-2价,且电负性E>B,则B为S,E为O,
(1)Fe的原子数序为26,电子排布式为1s22s22p63s23p63d64s2,故答案为:1s22s22p63s23p63d64s2;
(2)Fe、Co核外电子排布式分别为[Ar]3d64s2、[Ar]3d74s2,其第三电离能Fe的较小,故答案为:<;
(3)H2O和NH3都含有氢键,沸点较高,在常温下H2O为液态,NH3为气态,则沸点:H2O>NH3>H2S,
故答案为:H2O>NH3>H2S;
(4)E为O,与Co分别位于体心和棱、顶点和面心,则离子数分别为1+
×12=4,
×6+8×
=4,二者比值为1:1,则化学式为CoO,
故答案为:CoO;
(5)①HCN中,HCN的结构式为H-C≡N,C元素的杂化类型为sp,N元素的化合价为-3价,故答案为:sp;-3;
②Co的化合价由+2价升到+3价失去电子,生成[Co(CN)6]3-,所以H2O中的+1价H得电子生成H2,反应的方程式为
2[Co(CN)6]4-+2H2O
2[Co(CN)6]3-+H2↑+2OH-,故答案为:2[Co(CN)6]4-+2H2O
2[Co(CN)6]3-+H2↑+2OH-.
(1)Fe的原子数序为26,电子排布式为1s22s22p63s23p63d64s2,故答案为:1s22s22p63s23p63d64s2;
(2)Fe、Co核外电子排布式分别为[Ar]3d64s2、[Ar]3d74s2,其第三电离能Fe的较小,故答案为:<;
(3)H2O和NH3都含有氢键,沸点较高,在常温下H2O为液态,NH3为气态,则沸点:H2O>NH3>H2S,
故答案为:H2O>NH3>H2S;
(4)E为O,与Co分别位于体心和棱、顶点和面心,则离子数分别为1+
| 1 |
| 4 |
| 1 |
| 2 |
| 1 |
| 8 |
故答案为:CoO;
(5)①HCN中,HCN的结构式为H-C≡N,C元素的杂化类型为sp,N元素的化合价为-3价,故答案为:sp;-3;
②Co的化合价由+2价升到+3价失去电子,生成[Co(CN)6]3-,所以H2O中的+1价H得电子生成H2,反应的方程式为
2[Co(CN)6]4-+2H2O
| ||
| ||
点评:本题考查较为综合,题目难度较大,涉及电子排布式、电离能、氢键、晶胞的计算以及配合物等知识,易错点为(5),注意根据题给信息进行判断,学习中注意把握元素周期律的递变性.

练习册系列答案
 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案
相关题目





