摘要:本试卷分为第Ⅰ卷.第Ⅱ卷.满分100分.考试时间为75分钟. 可能用到的元素的相对原子质量:H-1 C-12 N-14 O-16 Na-23 Cl-35.5 Fe-56 第Ⅰ卷
网址:http://m.1010jiajiao.com/timu3_id_256260[举报]
下列说法正确的是( )
| A、燃烧一定要用火去点燃 | B、已知镓元素位于周期表中第4周期第ⅢA族,根据镓酸的酸性比偏铝酸强,所以镓的金属性比铝弱 | C、2013年诺贝尔化学奖授予三位美国化学家,以表彰他们设计出多尺度复杂化学系统模型,将传统化学实验搬到了网络世界.这一完美结合现实与理论的化学系统模型,为更全面了解并预测化学反应进程奠定了基础 | D、化肥的使用有效地提高了农作物的产量,常见的氮肥可分为铵态氮肥和硝态氮肥,硝酸盐和尿素都属于硝态氮肥 |
某工厂的废水中含有FeSO4、H2SO4、Ag2SO4、Al2(SO4)3及一些污泥.某研究性学习课题组测定了废水中各物质的含量并查找了溶解度数据,现列表如下:
表一废水中各物质的含量
表二 FeSO4和Al2(SO4)3在水中的溶解度
该课题组根据表中数据,设计了污水处理方案,拟利用该厂的废铁屑(有少量锈斑)、烧碱溶液和硫酸处理此污水,回收FeSO4?7H2O和Ag.
(1)请填写下列空白,完成得到Ag的实验方案:
①将带有锈斑的废铁屑先后用热的烧碱溶液和热水进行洗涤,目的是
②将工厂废水过滤,用少量水洗涤滤渣,洗涤液并入滤液后保留待用;
③
④
(2)请写出后续的步骤,除去Al3+,得到主要成分为FeSO4?7H2O晶体.
⑤将第
(3)写出步骤③中所有化学反应的离子方程式
(4)在步骤⑤中,加入少量硫酸调节pH的目的是
查看习题详情和答案>>
表一废水中各物质的含量
| 物质 | FeSO4 | H2SO4 | Ag2SO4 | Al2(SO4)2 | 污泥 |
| 质量分数/(%) | 15.0 | 7.0 | 0.40 | 0.34 | 5.0 |
| 温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 |
| FeSO4溶液度(g) | 15.6 | 20.5 | 26.5 | 32.9 | 40.2 | 48.6 |
| Al2(SO4)3溶解度(g) | 31.2 | 33.5 | 36.4 | 40.4 | 45.7 | 52.2 |
(1)请填写下列空白,完成得到Ag的实验方案:
①将带有锈斑的废铁屑先后用热的烧碱溶液和热水进行洗涤,目的是
去除油污
去除油污
.②将工厂废水过滤,用少量水洗涤滤渣,洗涤液并入滤液后保留待用;
③
在②的滤液中加入稍过量的洗涤过的废铁屑,充分反应后过滤
在②的滤液中加入稍过量的洗涤过的废铁屑,充分反应后过滤
,目的是使Ag+全部还原为金属Ag;④
将③的滤渣溶入足量的稀硫酸,过滤,滤液保留待用
将③的滤渣溶入足量的稀硫酸,过滤,滤液保留待用
,目的是分离出Ag;(2)请写出后续的步骤,除去Al3+,得到主要成分为FeSO4?7H2O晶体.
⑤将第
③
③
步与第④步所得滤液混合后,加入少量硫酸至混合液的pH为3-4后,将溶液加热(温度不超过80℃)蒸发浓缩,冷却结晶
将溶液加热(温度不超过80℃)蒸发浓缩,冷却结晶
,滤出FeSO4?7H2O晶体(3)写出步骤③中所有化学反应的离子方程式
Fe+2Ag+=Fe2++2Ag;Fe2O3+6H+=2Fe3++3H2O;Fe+2Fe3+=3Fe2+;Fe+2H+=Fe2++H2↑;
Fe+2Ag+=Fe2++2Ag;Fe2O3+6H+=2Fe3++3H2O;Fe+2Fe3+=3Fe2+;Fe+2H+=Fe2++H2↑;
.(4)在步骤⑤中,加入少量硫酸调节pH的目的是
抑制Fe2+的水解
抑制Fe2+的水解
.某小组同学欲研究SO2的性质.
(1)将相关的含硫物质分为如下表所示3组,第2组中物质X的化学式是
(2)利用如图所示的装置研究SO2的性质:
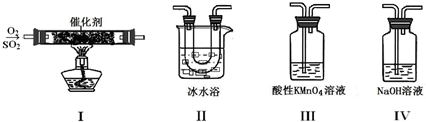
(熔点:SO2 76.1℃,SO3 16.8℃;沸点:SO2 10℃,SO3 45℃)
①装置I模拟工业生产中SO2催化氧化的反应,其化学方程式是
②甲同学按I、II、III、IV的顺序连接装置,装置II的作用是;装置III中溶液逐渐褪色,生成Mn2+,则该反应的离子方程式是
③乙同学按I、II、IV的顺序连接装置,若装置IV中有40mL 2.5mol?L-1NaOH溶液,反应后增重4.8g,则装置IV中发生总反应的化学方程式是
查看习题详情和答案>>
(1)将相关的含硫物质分为如下表所示3组,第2组中物质X的化学式是
H2SO3
H2SO3
.| 第1组 | 第2组 | 第3组 |
| S(单质) | SO2、X、Na2SO3、NaHSO3 | SO3、H2SO4、Na2SO4、NaHSO4 |

(熔点:SO2 76.1℃,SO3 16.8℃;沸点:SO2 10℃,SO3 45℃)
①装置I模拟工业生产中SO2催化氧化的反应,其化学方程式是
2SO2+O2
2SO3
| ||
| △ |
2SO2+O2
2SO3
.
| ||
| △ |
②甲同学按I、II、III、IV的顺序连接装置,装置II的作用是;装置III中溶液逐渐褪色,生成Mn2+,则该反应的离子方程式是
5SO2+2H2O+2MnO4=5SO42-+2Mn2++4H+
5SO2+2H2O+2MnO4=5SO42-+2Mn2++4H+
.③乙同学按I、II、IV的顺序连接装置,若装置IV中有40mL 2.5mol?L-1NaOH溶液,反应后增重4.8g,则装置IV中发生总反应的化学方程式是
3SO2+4NaOH═Na2SO3+2NaHSO3+H2O
3SO2+4NaOH═Na2SO3+2NaHSO3+H2O
.A、B、C、D是四种短周期元素,E是过渡元素.A、B、C同周期,C、D同主族,A的原子结构示意图为: ,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2.回答下列问题:
,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2.回答下列问题:
(1)画出D的轨道表示式

(2)用化学式表示上述五种元素中最高价氧化物对应水化物酸性最强的是
(3)用元素符号表示D所在周期(除稀有气体元素外)第一电离能最大的元素是
(4)D的氢化物比C的氢化物的沸点
(5)E元素在周期表的第
(6)A、C最高价氧化物的晶体类型是分别是
查看习题详情和答案>>
 ,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2.回答下列问题:
,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2.回答下列问题:(1)画出D的轨道表示式


(2)用化学式表示上述五种元素中最高价氧化物对应水化物酸性最强的是
HNO3
HNO3
,碱性最强的是NaOH
NaOH
.(3)用元素符号表示D所在周期(除稀有气体元素外)第一电离能最大的元素是
F
F
.(4)D的氢化物比C的氢化物的沸点
高
高
(填“高“或“低“),原因:氨气分子之间含有氢键
氨气分子之间含有氢键
;D的液态氢化物是一种重要的溶剂,其性质与H2O相似,写出B与D的液态氢化物反应的化学方程式2Na+2NH3═2NaNH2+H2↑
2Na+2NH3═2NaNH2+H2↑
.(5)E元素在周期表的第
第四周期第Ⅷ族
第四周期第Ⅷ族
族,已知元素周期表可按电子排布分为s区、p区等,则E元素在d
d
区.(6)A、C最高价氧化物的晶体类型是分别是
原子
原子
晶体、分子
分子
晶体.
锌锰废电池经处理后,生产并回收硫酸锌及碳酸锰,其中生产工业级碳酸锰工艺如图:
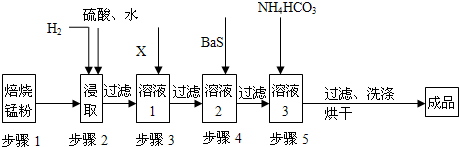
试回答下列问题
(1)锰在元素周期表中第 周期,第 族.
(2)步骤1和步骤2是将MnO2等转化为MnO并溶于硫酸,其中步骤2中的氢气,是另一个流程产生的副产品,请写出产生氢气的反应方程式 .
(3)步骤3和步骤4都是除杂质
①X是一种“绿色”氧化剂,则X是 (填化学式).
②步骤3是除去杂质Fe2+.请用文字和必要的方程式简述除去Fe2+的方法 (已知三种离子沉淀的pH范围为Fe3+:2.7~3.7,Mn2+:8.6~10.1,Fe2+:7.6~9.6.) .
③步骤4中主要反应方程式为:MeSO4+BaS=MeS↓+BaSO4↓(Me主要为Pb、Cd、Hg等),则其除去杂质的原理是 .
(4)已知进行步骤5的操作时,溶液3(主要成分为MnSO4)会产生大量无色无味的气泡,则步骤5反应的化学方程式为 .
查看习题详情和答案>>

试回答下列问题
(1)锰在元素周期表中第
(2)步骤1和步骤2是将MnO2等转化为MnO并溶于硫酸,其中步骤2中的氢气,是另一个流程产生的副产品,请写出产生氢气的反应方程式
(3)步骤3和步骤4都是除杂质
①X是一种“绿色”氧化剂,则X是
②步骤3是除去杂质Fe2+.请用文字和必要的方程式简述除去Fe2+的方法 (已知三种离子沉淀的pH范围为Fe3+:2.7~3.7,Mn2+:8.6~10.1,Fe2+:7.6~9.6.)
③步骤4中主要反应方程式为:MeSO4+BaS=MeS↓+BaSO4↓(Me主要为Pb、Cd、Hg等),则其除去杂质的原理是
(4)已知进行步骤5的操作时,溶液3(主要成分为MnSO4)会产生大量无色无味的气泡,则步骤5反应的化学方程式为