摘要:下列叙述正确的是:A.H+的摩尔质量是1g,B.H+的摩尔质量是1 g/mol, C.H+的摩尔质量是1,D.H+的摩尔质量是1 mol.
网址:http://m.1010jiajiao.com/timu3_id_256013[举报]
如图是由Emil Zmaczynski设计的金字塔式元素周期表的一部分,图上标有第ⅥA族和几种元素的位置.请回答下列问题:

(1)如图中将铁元素在周期表中的位置是______
(2)自从周期表诞生以来,关于氢元素在周期表中的位置,一直存在纷争,有人主张把它放在第ⅦA族,理由是:氢的最外层电子“饱和缺一”.请写出NaH的电子式______
(3)b元素的氢化物与其最高价氧化物的水化物可生成一种盐,该盐溶于水时______(“抑制”、“促进”或“不影响”)水电离,其反应的离子方程式为______.
(4)下列叙述正确的是______.
A.h的最高价氧化物对应的水化物是一种强碱
B.f的氢化物比硒化氢的稳定性弱
C.c的氢化物的水溶液是强酸
D.原子半径:h>e>a
E.相同条件下,d与f形成的化合物水溶液的pH大于d与g形成的化合物水溶液的pH,说明相同浓度氢化物水溶液的酸性f弱于g
(5)d的某化合物呈淡黄色,可与氯化亚铁溶液反应.若淡黄色固体与氯化亚铁的物质的量之比为1:2,且无气体生成,则该反应的离子方程式为:______.
查看习题详情和答案>>

(1)如图中将铁元素在周期表中的位置是______
(2)自从周期表诞生以来,关于氢元素在周期表中的位置,一直存在纷争,有人主张把它放在第ⅦA族,理由是:氢的最外层电子“饱和缺一”.请写出NaH的电子式______
(3)b元素的氢化物与其最高价氧化物的水化物可生成一种盐,该盐溶于水时______(“抑制”、“促进”或“不影响”)水电离,其反应的离子方程式为______.
(4)下列叙述正确的是______.
A.h的最高价氧化物对应的水化物是一种强碱
B.f的氢化物比硒化氢的稳定性弱
C.c的氢化物的水溶液是强酸
D.原子半径:h>e>a
E.相同条件下,d与f形成的化合物水溶液的pH大于d与g形成的化合物水溶液的pH,说明相同浓度氢化物水溶液的酸性f弱于g
(5)d的某化合物呈淡黄色,可与氯化亚铁溶液反应.若淡黄色固体与氯化亚铁的物质的量之比为1:2,且无气体生成,则该反应的离子方程式为:______.
查看习题详情和答案>>
如图是由Emil Zmaczynski设计的金字塔式元素周期表的一部分,图上标有第ⅥA族和几种元素的位置.请回答下列问题:

(1)如图中将铁元素在周期表中的位置是______
(2)自从周期表诞生以来,关于氢元素在周期表中的位置,一直存在纷争,有人主张把它放在第ⅦA族,理由是:氢的最外层电子“饱和缺一”.请写出NaH的电子式______
(3)b元素的氢化物与其最高价氧化物的水化物可生成一种盐,该盐溶于水时______(“抑制”、“促进”或“不影响”)水电离,其反应的离子方程式为______.
(4)下列叙述正确的是______.
A.h的最高价氧化物对应的水化物是一种强碱
B.f的氢化物比硒化氢的稳定性弱
C.c的氢化物的水溶液是强酸
D.原子半径:h>e>a
E.相同条件下,d与f形成的化合物水溶液的pH大于d与g形成的化合物水溶液的pH,说明相同浓度氢化物水溶液的酸性f弱于g
(5)d的某化合物呈淡黄色,可与氯化亚铁溶液反应.若淡黄色固体与氯化亚铁的物质的量之比为1:2,且无气体生成,则该反应的离子方程式为:______.
查看习题详情和答案>>

(1)如图中将铁元素在周期表中的位置是______
(2)自从周期表诞生以来,关于氢元素在周期表中的位置,一直存在纷争,有人主张把它放在第ⅦA族,理由是:氢的最外层电子“饱和缺一”.请写出NaH的电子式______
(3)b元素的氢化物与其最高价氧化物的水化物可生成一种盐,该盐溶于水时______(“抑制”、“促进”或“不影响”)水电离,其反应的离子方程式为______.
(4)下列叙述正确的是______.
A.h的最高价氧化物对应的水化物是一种强碱
B.f的氢化物比硒化氢的稳定性弱
C.c的氢化物的水溶液是强酸
D.原子半径:h>e>a
E.相同条件下,d与f形成的化合物水溶液的pH大于d与g形成的化合物水溶液的pH,说明相同浓度氢化物水溶液的酸性f弱于g
(5)d的某化合物呈淡黄色,可与氯化亚铁溶液反应.若淡黄色固体与氯化亚铁的物质的量之比为1:2,且无气体生成,则该反应的离子方程式为:______.
下图是由Emil Zmaczynski设计的金字塔式元素周期表的一部分,图上标有第ⅥA族和几种元素的位置.请回答下列问题:
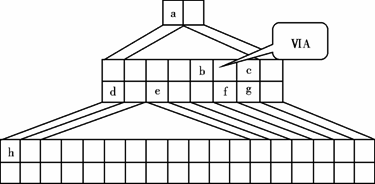
(1)请在上图中将铁元素所在族的位置全部涂黑.
(2)自从周期表诞生以来,关于氢元素在周期表中的位置,一直存在纷争,有人主张把它放在第ⅦA族,理由是:氢的最外层电子“饱和缺一”.请写出NaH的电子式________.
(3)b元素的氢化物与其最高价氧化物的水化物可生成一种盐,土壤中施用该盐做化肥时,其阴离子在水田中的利用率低,说明土壤胶体粒子带________(“正”或“负”)电荷.
(4)下列叙述正确的是________.
A.h的最高价氧化物对应的水化物是一种强碱
B.硒化氢的稳定性强于f的氢化物的稳定性
C.c的氢化物的水溶液是强酸
D.原子半径:h>e>a
E.相同条件下,d与f形成的化合物水溶液的pH大于d与g形成的化合物水溶液的pH,说明相同浓度氢化物水溶液的酸性f弱于g
(5)d的某化合物呈淡黄色,可与氯化亚铁溶液反应生成红褐色沉淀和能使带火星的木条复燃的气体,若沉淀和气体的物质的量之比为2∶1,反应的离子方程式为________.
自然界中的水要经过消毒杀菌才可成为生活饮用水.ClO2是一种高效安全灭菌消毒剂,其中Cl化合价为+4价.
(1)氯原子最外层有 种能量不同的电子,某化合物中O的化合价与ClO2中O的化合价恰好相反,写出该化合物的分子式 .
(2)下列可用作比较S和C非金属性强弱依据的是 .
A.CS2中各元素的化合价
B.气态氢化物的稳定性
C.元素在周期表中的位置
D.最高价含氧酸的酸性
(3)以下性质的比较正确的是 .
A.键长:HF>HCl
B.稳定性:HF>HCl
C.酸性:HF>HCl
D.沸点:HF>HCl
(4)O3也是一种很好的消毒剂,具有高效、洁净、方便、经济等优点.O3可溶于水,在水中易分解,产生的[O]为游离氧原子,有很强的杀菌消毒能力.常温常压下发生反应如下:
反应①O3═O2+[O]-Q平衡常数为K1;
反应②[O]+O3═2O2+Q平衡常数为K2;
总反应:2O3═3O2+Q平衡常数为K.
一定条件下,O3的浓度减少一半所需的时间(t)如表所示.已知:O3的起始浓度为0.0216mol/L.在30°C、pH=4.0条件下,O3的分解速率为 mol/(L?min).
(5)根据表中数据,推测O3在下列条件下分解速率由小到大的顺序为 .(填字母代号)
A.40°C、pH=3.0
B.10°C、pH=4.0
C.30°C、pH=7.0
(6)下列叙述正确的是 .
A.降低温度,K增大
B.K=K1+K2
C.适当升温,可提高消毒效率
D.压强增大,K2减小.
查看习题详情和答案>>
(1)氯原子最外层有
(2)下列可用作比较S和C非金属性强弱依据的是
A.CS2中各元素的化合价
B.气态氢化物的稳定性
C.元素在周期表中的位置
D.最高价含氧酸的酸性
(3)以下性质的比较正确的是
A.键长:HF>HCl
B.稳定性:HF>HCl
C.酸性:HF>HCl
D.沸点:HF>HCl
(4)O3也是一种很好的消毒剂,具有高效、洁净、方便、经济等优点.O3可溶于水,在水中易分解,产生的[O]为游离氧原子,有很强的杀菌消毒能力.常温常压下发生反应如下:
反应①O3═O2+[O]-Q平衡常数为K1;
反应②[O]+O3═2O2+Q平衡常数为K2;
总反应:2O3═3O2+Q平衡常数为K.
一定条件下,O3的浓度减少一半所需的时间(t)如表所示.已知:O3的起始浓度为0.0216mol/L.在30°C、pH=4.0条件下,O3的分解速率为
| T/℃t/min pH | 3.0 | 4.0 | 5.0 | 6.0 | 20 | 301 | 231 | 169 | 58 | 30 | 158 | 108 | 48 | 15 | 50 | 31 | 26 | 15 | 7 |
A.40°C、pH=3.0
B.10°C、pH=4.0
C.30°C、pH=7.0
(6)下列叙述正确的是
A.降低温度,K增大
B.K=K1+K2
C.适当升温,可提高消毒效率
D.压强增大,K2减小.
[化学--选修2化学与技术]二氧化硫在工业制硫酸中有着重要作用,但又是煤燃烧的有害气体.按“循环经济”的模式,就是要将SO2收集起来,把它变为有用的东西.
(1)某空气监测是根据SO2和溴水的定量反应来测定SO2的含量.该反应的化学方程式为 .
(2)若每次取样的空气为200mL,通入足量的溴水中,测得平均有2.408×1018个电子转移,则SO2的含量为 mg?L-1,若规定空气中SO2含量不得超过0.02mg?L-1,则样气是否符合大气的质量标准 (填“符合”或“不符合”).
(3)向氯酸钠的酸性水溶液中通入二氧化硫,该反应中氧化过程的反应式为:SO2+2H2O-2e-→SO42-+4H+;向亚氯酸钠(NaClO2)固体中通入用空气稀释的氯气,该反应中还原过程的反应式为:Cl2+2e-→2Cl-.在上述两个反应中均会生成产物X,则X的化学式为 .
A. NaClO B.NaClO4 C.HClO D.ClO2
(4)在硫酸工业制法中,下列叙述正确的是 .
A.硫铁矿燃烧前要粉碎,因为大块的黄铁矿不能在空气中反应
B.从沸腾炉出来的气体要净化,因为炉气中的SO2会与杂质反应
C.SO2氧化成SO3要用催化剂,这样可提高SO2的转化率
D.SO3用98.3%的浓硫酸来吸收,目的是为了防止形成酸雾,以提高SO3吸收效率
(5)如表是压强对SO2平衡转化率的影响
对于SO2转化SO3的反应,增大压强可使转化率 (填“增大”、“减少”或“不变”),但在实际工业生产中常采用常压条件,理由是 .
查看习题详情和答案>>
(1)某空气监测是根据SO2和溴水的定量反应来测定SO2的含量.该反应的化学方程式为
(2)若每次取样的空气为200mL,通入足量的溴水中,测得平均有2.408×1018个电子转移,则SO2的含量为
(3)向氯酸钠的酸性水溶液中通入二氧化硫,该反应中氧化过程的反应式为:SO2+2H2O-2e-→SO42-+4H+;向亚氯酸钠(NaClO2)固体中通入用空气稀释的氯气,该反应中还原过程的反应式为:Cl2+2e-→2Cl-.在上述两个反应中均会生成产物X,则X的化学式为
A. NaClO B.NaClO4 C.HClO D.ClO2
(4)在硫酸工业制法中,下列叙述正确的是
A.硫铁矿燃烧前要粉碎,因为大块的黄铁矿不能在空气中反应
B.从沸腾炉出来的气体要净化,因为炉气中的SO2会与杂质反应
C.SO2氧化成SO3要用催化剂,这样可提高SO2的转化率
D.SO3用98.3%的浓硫酸来吸收,目的是为了防止形成酸雾,以提高SO3吸收效率
(5)如表是压强对SO2平衡转化率的影响
| 压强MPa 转化率% 温度℃ |
0.1 | 0.5 | 1 | 10 |
| 400 | 99.2 | 99.6 | 99.7 | 99.9 |