网址:http://m.1010jiajiao.com/timu3_id_255521[举报]
B.肼沸点高达l13℃,可推测肼分子间可形成氢键
C.肼燃烧的热化学方程式为:N2H4(g)+O2(g) = N2(g) +2H2O(g);△H=-642 kJ·mol-1
D.肼-氧气燃料电池,负极的电极反应为:O2+2H2O+4e-=4OH-
(共14分)氟是一种氧化性极强的非金属元素,它甚至能与稀有气体氙反应生成XeF2、XeF4、XeF6等固体,这些固体都极易与水反应。其中XeF2与H2O仅发生氧化还原反应,而XeF4与H2O反应时,有一半的XeF4与H2O发生氧化还原反应,另一半则发生歧化反应:3Xe(Ⅳ)→Xe+2Xe(Ⅵ)。XeF6则发生非氧化还原反应完全水解。试回答下列问题:
(1) 写出XeF4与H2O反应的方程式 ;
(2) 14.72gXeF6完全水解后,再加入100mL 0.600mol?L-1 Mn2+的水溶液,反应完全后,放出的气体干燥后再通过红热的金属铜,体积减少20%。
① 通过计算可确定Mn2+的氧化产物为 ,相应的化学方程式为:
;
② 将所得溶液稀释到1000mL后,求溶液pH以及氟离子浓度。(已知弱酸HF在水溶液中存在电离平衡,Ka=![]() =3.5×10-4)溶液的pH为 ,F-浓度为 mol?L-1。
=3.5×10-4)溶液的pH为 ,F-浓度为 mol?L-1。
(3) 合成XeF2、XeF4、XeF6时通常用Ni制反应容器,使用前用F2使之钝化。
① 上述化合物的分子构型分别是 ;
② 使用Ni制反应容器前用F2钝化的两个主要原因是
;
③ 红外光谱和电子衍射表明XeF6的结构绕一个三重轴发生畸变。画出XeF6结构发生畸变的示意图:
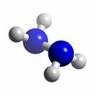
查看习题详情和答案>>肼(N2H4)分子中所有原子均达到稀有气体原子的稳定结构,它的沸点高达113℃,燃烧热为642 kJ·mol-1,肼与氧气及氢氧化钾溶液还可构成燃料电池。已知肼的球棍模型如图所示,下列有关说法正确的是( )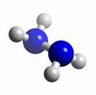
| A.肼是由极性键和非极性键构成的非极性分子 |
| B.肼沸点高达l13℃,可推测肼分子间能形成氢键 |
| C.肼燃烧的热化学方程式为:N2H4(g)+ O2(g) = N2(g) +2H2O(g);△H = -642 kJ·mol-1 |
| D.肼-氧气燃料电池,负极的电极反应为:O2 +2H2O+4e-=4OH- |
I.下列分子中,属于非极性分子的是
A、SO2 B、BeCl2 C、BBr3 D、COCl2
II. 铜(Cu)是重要金属,Cu的化合物在科学研究和工业生产中具有许多用途,如CuSO4溶液常用作电解液、电镀液等。请回答以下问题:
(1)Cu+基态核外电子排布式为 _______________ 。
(2)CuSO4可由金属铜与浓硫酸反应制备,该反应的化学方程式为:______________ ___;
CuSO4粉末常用来检验一些有机物中的微量水分,其原因是______________________ _;
(3)SO42-的立体构型是__________,其中S原子的杂化轨道类型是____ ;
(4)元素金(Au)处于周期表中的第六周期,与Cu同族,一种铜合金晶体具有立方最密堆积的结构,在晶胞中Cu原子处于面心,Au原子处于顶点位置,则该合金中Cu原子与Au原子数量之比为_______;该晶体中,粒子之间的作用力是__________;
(5)ZnS在荧光体、光导体材料、涂料、颜料等行业中应用广泛。立方ZnS晶体结构如下图所示,其晶胞边长为540.0 pm.密度为 (列式并计算)

查看习题详情和答案>>