题目内容
I.下列分子中,属于非极性分子的是
A、SO2 B、BeCl2 C、BBr3 D、COCl2
II. 铜(Cu)是重要金属,Cu的化合物在科学研究和工业生产中具有许多用途,如CuSO4溶液常用作电解液、电镀液等。请回答以下问题:
(1)Cu+基态核外电子排布式为 _______________ 。
(2)CuSO4可由金属铜与浓硫酸反应制备,该反应的化学方程式为:______________ ___;
CuSO4粉末常用来检验一些有机物中的微量水分,其原因是______________________ _;
(3)SO42-的立体构型是__________,其中S原子的杂化轨道类型是____ ;
(4)元素金(Au)处于周期表中的第六周期,与Cu同族,一种铜合金晶体具有立方最密堆积的结构,在晶胞中Cu原子处于面心,Au原子处于顶点位置,则该合金中Cu原子与Au原子数量之比为_______;该晶体中,粒子之间的作用力是__________;
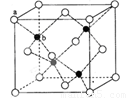
(5)ZnS在荧光体、光导体材料、涂料、颜料等行业中应用广泛。立方ZnS晶体结构如下图所示,其晶胞边长为540.0 pm.密度为 (列式并计算)
I.BC
II.(1)1s22s22p63s23p63d10
(2)Cu+2 H2SO4(浓)△CuSO4+SO2↑+ 2H2O;
白色无水硫酸铜可与水结合生成蓝色的CuSO4·5H2O,显示水合铜离子特征蓝色;
(3)正四面体,sp3;(4)3:1;金属键;(5) 4.1
【解析】
试题分析:I.对于ABn型分子,若A原子的最外层电子均参与成键,该分子为非极性分子,否则为极性分子。BeCl2和BBr3为非极性分子,SO2为极性分子。COCl2的分子结构为碳上连一个双键氧,然后左右各一个氯,键角约111.8°,它们的正负电荷中心不是重合的,是极性分子,故属于非极性分子为BC。
II.(1)Cu为29号元素,Cu+的电子数为28,故Cu+基态核外电子排布式为1s22s22p63s23p63d10 。
(2)浓硫酸具有强氧化性,Cu与浓硫酸加热可生成CuSO4、SO2和H2O,配平可得化学方程式;白色的CuSO4粉末与水反应生成蓝色的CuSO4•5H2O,可用于水的检验。
(3)硫酸根中心原子的价层电子对为:孤对电子数6-2×4+2=0,成键电子对数4,所以为正四面体结构,中心原子为sp3杂化。
(4)Au电 子排布类似Cu,只是电子层多两层,由于是面心立方,晶胞内N(Cu)=6×1/2=3,N(Au)=8×1/8=1,所以Cu原子与Au原子数量之比为3:1;金属晶体内粒子间作用力为金属键。
(5)根据立方ZnS的晶体结构可知,1个ZnS晶胞含有4个Zn2+和4个S2‾,所以ZnS晶体的密度为: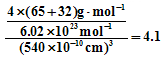
考点:本题考查分子的极性、电子排布式的书写、杂化方式和立体结构、晶胞的计算。

 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案 .
.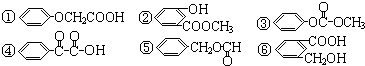

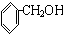 )氧化生成,写出该反应的化学方程式
)氧化生成,写出该反应的化学方程式
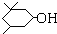 )经硫酸催化而生成,写出该反应的化学方程式
)经硫酸催化而生成,写出该反应的化学方程式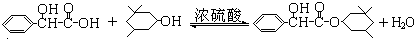
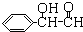 B.M可能是乙二酸
B.M可能是乙二酸